[Bài tập trắc nghiệm Hóa Lớp 11 Kết nối tri thức] Trắc nghiệm hóa 11 bài 1 kết nối tri thức có đáp án
Hướng dẫn học bài: Trắc nghiệm hóa 11 bài 1 kết nối tri thức có đáp án - Môn Hóa học Lớp 11 Lớp 11. Đây là sách giáo khoa nằm trong bộ sách 'Bài tập trắc nghiệm Hóa Lớp 11 Kết nối tri thức Lớp 11' được biên soạn theo chương trình đổi mới của Bộ giáo dục. Hi vọng, với cách hướng dẫn cụ thể và giải chi tiết các bé sẽ nắm bài học tốt hơn.
Đề bài
Cho cân bằng: \(2S{O_{2(k)}} + {O_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_{3(k)}}\)
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này
Phản ứng thuận tỏa nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
Cho cân bằng hóa học:
\({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)
Phản ứng thuận là phản ứng tỏa nhiệt. Cân bằng hóa học không bị chuyển dịch khi:
Một bình phản ứng có dung tích không đổi, chứa hỗn hợp khí N2 và H2 với nồng độ tương ứng là 0,3M và 0,7M. Sau khi phản ứng tổng hợp NH3 đạt trạng thái cân bằng ở toC, H2 chiếm 50% thể tích hỗn hợp thu được. Hằng số cân bằng KC ở toC của phản ứng có giá trị là:
Cho cân bằng hóa học sau: \(2S{O_{2(k)}} + {O_{2(k)}} \to 2S{O_{3(k)}}\); ∆H<0
Yếu tố nào sau đây làm cân bằng chuyển dịch theo chiều thuận
(1) tăng nhiệt độ
(2) hạ nhiệt độ
(3) tăng áp suất
(4) giảm nồng độ SO2
(5) tăng nồng độ SO2
(6) thêm chất xúc tác
Cho cân bằng hóa học: \({H_{2(k)}} + {I_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2H{I_{(k)}}\)∆H>0.
Cân bằng không bị chuyển dịch khi:
Cho cân bằng sau trong bình kín:
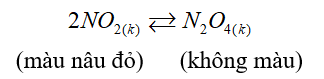
Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có:
Cho phản ứng hóa học sau:
\({H_{2(k)}} + {I_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2H{I_{(k)}}\)
Nồng độ các chất lúc cân bằng ở nhiệt độ 430℃ như sau:
(H2) = (I2) = 0,107M; (HI)=0,768M
Tính hằng số cân bằng KC của phản ứng ở 430℃.
Một bình phản ứng có dung tích không đổi, chứa hỗn hợp khí N2 và H2 với nồng độ tương ứng là 0,3M và 0,7M. Sau khi phản ứng tổng hợp NH3 đạt trạng thái cân bằng ở toC, H2 chiếm 50% thể tích hỗn hợp thu được. Hằng số cân bằng KC ở toC của phản ứng có giá trị là:
Cho cân bằng hóa học sau: \(2S{O_{2(k)}} + {O_{2(k)}} \to 2S{O_{3(k)}}\); ∆H<0
Các yếu tố nào sau đây làm cân bằng chuyển dịch theo chiều thuận:
(1) Tăng nhiệt độ
(2) Hạ nhiệt độ
(3) Tăng áp suất
(4) Thêm xúc tác
(5) Tăng nồng độ SO2
(6) Tăng nồng độ SO3
Cho cân bằng: \(2S{O_{2(k)}} + {O_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_{3(k)}}\)
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này
Phản ứng thuận tỏa nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
Cho cân bằng hóa học:
\({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)
Phản ứng thuận là phản ứng tỏa nhiệt. Cân bằng hóa học không bị chuyển dịch khi:
Cho cân bằng hóa học: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)
Cân bằng trên chuyển dịch theo chiều thuận khi:
Cho biết mối quan hệ giữa các giá trị KC của các phản ứng sau:
(1) \(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\)
(2) \(S{O_2}(g) + \frac{1}{2}{O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} S{O_3}(g)\)
(3) \(2S{O_3}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_2}(g) + {O_2}(g)\)
Người ta cho N2 và H2 vào trong bình kín dung tích không đổi và thực hiện phản ứng:
\({N_2}(g) + 3{H_2} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}\)
Sau một thời gian, nồng độ các chất trong bình như sau: [N2] = 2M; [H2] = 3M; [NH3] = 2M. Nồng độ mol/l của N2 và H2 ban đầu lần lượt là:
Lời giải và đáp án
Cho cân bằng: \(2S{O_{2(k)}} + {O_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_{3(k)}}\)
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này
Phản ứng thuận tỏa nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
Đáp án : D
Phương pháp: Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Khi tăng nhiệt độ tỉ khối của hỗn hợp khí so với H2 giảm đi chứng tỏ phản ứng dịch theo chiều nghịch. Vì vậy, đây là phản ứng tỏa nhiệt.
Cho cân bằng hóa học:
\({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)
Phản ứng thuận là phản ứng tỏa nhiệt. Cân bằng hóa học không bị chuyển dịch khi:
Đáp án : D
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Ta có: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) (∆H<0)
Chất xúc tác chỉ làm tăng tốc độ phản ứng chứ không làm thay đổi cân bằng.
Một bình phản ứng có dung tích không đổi, chứa hỗn hợp khí N2 và H2 với nồng độ tương ứng là 0,3M và 0,7M. Sau khi phản ứng tổng hợp NH3 đạt trạng thái cân bằng ở toC, H2 chiếm 50% thể tích hỗn hợp thu được. Hằng số cân bằng KC ở toC của phản ứng có giá trị là:
Đáp án : B
Dựa vào kiến thức về hằng số cân bằng.
aA + bB → cC + dD
Ở trạng thái cân bằng, hằng số cân bằng KC của phản ứng được xác định theo biểu thức:
\({K_C} = \frac{{{{{\rm{(}}C{\rm{)}}}^{\rm{c}}}{{{\rm{(}}D{\rm{)}}}^d}}}{{{{{\rm{(}}A)}^a}{{(B{\rm{)}}}^b}}}\)
Ta có: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)(1)
Gọi (N2) phản ứng là a => theo phản ứng (1): (H2) phản ứng là 3a; (NH3) phản ứng là 2a.
Ở trạng thái cân bằng: (N2) = 0,3-a; (H2) = 0,7-a
Để đơn giản ta xét 1 lít hỗn hợp.
Sau khi phản ứng cân bằng: 0,3 – a + 0,7 – 3a + 2a= 1 – 2a
Mặt khác % thể tích H2 = 50% = \(\frac{{0,7 - 3a}}{{1 - 2a}}\).100 => a = 0,1.
Khi đạt cân bằng (N2) = 0,3 – 0,1 = 0,2 (M)
(H2) = 0,7 – 0,3 = 0,4 (M)
(NH3) = 0,2 (M).
Vậy \({K_C} = \frac{{{{{\rm{(0,2)}}}^2}}}{{{\rm{(0,2}}){{{\rm{(}}0,4)}^3}}} = \)= 3,125
Cho cân bằng hóa học sau: \(2S{O_{2(k)}} + {O_{2(k)}} \to 2S{O_{3(k)}}\); ∆H<0
Yếu tố nào sau đây làm cân bằng chuyển dịch theo chiều thuận
(1) tăng nhiệt độ
(2) hạ nhiệt độ
(3) tăng áp suất
(4) giảm nồng độ SO2
(5) tăng nồng độ SO2
(6) thêm chất xúc tác
Đáp án : B
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Dựa vào phản ứng: \(2S{O_{2(k)}} + {O_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_{3(k)}}\); ∆H<0
-Đây là một phản ứng tỏa nhiệt (∆H<0).
-Có sự chênh lệch số mol trước và sau phản ứng.
Vì vậy các yếu tố làm cân bằng chuyển dịch theo chiều thuận là:
+Hạ nhiệt độ (2)
+Tăng áp suất (3)
+Tăng nồng độ SO2 (5)
Cho cân bằng hóa học: \({H_{2(k)}} + {I_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2H{I_{(k)}}\)∆H>0.
Cân bằng không bị chuyển dịch khi:
Đáp án : D
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Từ phản ứng \({H_{2(k)}} + {I_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2H{I_{(k)}}\)∆H>0.
-Đây là phản ứng thu nhiệt (∆H>0)
-Tổng số mol trước khi phản ứng = Tổng số mol sau khi phản ứng => Áp suất chung của hệ không làm thay đổi đến sự chuyển dịch cân bằng hóa học.
Cho cân bằng sau trong bình kín:
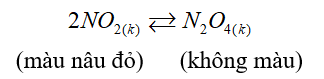
Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần. Phản ứng thuận có:
Đáp án : B
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
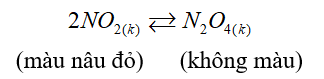
Khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần, chứng tỏ phản ứng xảy ra theo chiều thuận, vì vậy phản ứng trên là phản ứng tỏa nhiệt (∆H<0).
Cho phản ứng hóa học sau:
\({H_{2(k)}} + {I_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2H{I_{(k)}}\)
Nồng độ các chất lúc cân bằng ở nhiệt độ 430℃ như sau:
(H2) = (I2) = 0,107M; (HI)=0,768M
Tính hằng số cân bằng KC của phản ứng ở 430℃.
Đáp án : B
Dựa vào kiến thức về hằng số cân bằng.
aA + bB → cC + dD
Ở trạng thái cân bằng, hằng số cân bằng KC của phản ứng được xác định theo biểu thức:
\({K_C} = \frac{{{{{\rm{(}}C{\rm{)}}}^{\rm{c}}}{{{\rm{(}}D{\rm{)}}}^d}}}{{{{{\rm{(}}A)}^a}{{(B{\rm{)}}}^b}}}\)
Ta có: \({K_C} = \frac{{{{{\rm{(HI)}}}^2}}}{{{\rm{(}}{H_2})({I_2}{\rm{)}}}}\)
Thay các giá trị (HI) = 0,768M; (H2) = (I2) = 0,107M
Vậy \({K_C} = \frac{{{{{\rm{(0,768)}}}^2}}}{{{{{\rm{(0,107}})}^2}}}\)= 51,52
Một bình phản ứng có dung tích không đổi, chứa hỗn hợp khí N2 và H2 với nồng độ tương ứng là 0,3M và 0,7M. Sau khi phản ứng tổng hợp NH3 đạt trạng thái cân bằng ở toC, H2 chiếm 50% thể tích hỗn hợp thu được. Hằng số cân bằng KC ở toC của phản ứng có giá trị là:
Đáp án : B
Dựa vào kiến thức về hằng số cân bằng.
aA + bB → cC + dD
Ở trạng thái cân bằng, hằng số cân bằng KC của phản ứng được xác định theo biểu thức:
\({K_C} = \frac{{{{{\rm{(}}C{\rm{)}}}^{\rm{c}}}{{{\rm{(}}D{\rm{)}}}^d}}}{{{{{\rm{(}}A)}^a}{{(B{\rm{)}}}^b}}}\)
Ta có: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)(1)
Gọi (N2) phản ứng là a => theo phản ứng (1): (H2) phản ứng là 3a; (NH3) phản ứng là 2a.
Ở trạng thái cân bằng: (N2) = 0,3-a; (H2) = 0,7-a
Để đơn giản ta xét 1 lít hỗn hợp.
Sau khi phản ứng cân bằng: 0,3 – a + 0,7 – 3a + 2a= 1 – 2a
Mặt khác % thể tích H2 = 50% = \(\frac{{0,7 - 3a}}{{1 - 2a}}\).100 => a = 0,1.
Khi đạt cân bằng (N2) = 0,3 – 0,1 = 0,2 (M)
(H2) = 0,7 – 0,3 = 0,4 (M)
(NH3) = 0,2 (M).
Vậy \({K_C} = \frac{{{{{\rm{(0,2)}}}^2}}}{{{\rm{(0,2}}){{{\rm{(}}0,4)}^3}}} = \)= 3,125
Cho cân bằng hóa học sau: \(2S{O_{2(k)}} + {O_{2(k)}} \to 2S{O_{3(k)}}\); ∆H<0
Các yếu tố nào sau đây làm cân bằng chuyển dịch theo chiều thuận:
(1) Tăng nhiệt độ
(2) Hạ nhiệt độ
(3) Tăng áp suất
(4) Thêm xúc tác
(5) Tăng nồng độ SO2
(6) Tăng nồng độ SO3
Đáp án : B
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Dựa vào phản ứng: \(2S{O_{2(k)}} + {O_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_{3(k)}}\); ∆H<0
-Đây là một phản ứng tỏa nhiệt (∆H<0).
-Có sự chênh lệch số mol trước và sau phản ứng.
Vì vậy các yếu tố làm cân bằng chuyển dịch theo chiều thuận là:
+Hạ nhiệt độ (2)
+Tăng áp suất (3)
+Tăng nồng độ SO2 (5)
Cho cân bằng: \(2S{O_{2(k)}} + {O_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_{3(k)}}\)
Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này
Phản ứng thuận tỏa nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
Đáp án : D
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Khi tăng nhiệt độ tỉ khối của hỗn hợp khí so với H2 giảm đi chứng tỏ phản ứng dịch theo chiều nghịch. Vì vậy, đây là phản ứng tỏa nhiệt.
Cho cân bằng hóa học:
\({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)
Phản ứng thuận là phản ứng tỏa nhiệt. Cân bằng hóa học không bị chuyển dịch khi:
Đáp án : D
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Ta có: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\) (∆H<0)
Chất xúc tác chỉ làm tăng tốc độ phản ứng chứ không làm thay đổi cân bằng.
Cho cân bằng hóa học: \({N_{2(k)}} + 3{H_{2(k)}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_{3(k)}}\)
Cân bằng trên chuyển dịch theo chiều thuận khi:
Đáp án : C
Dựa vào kiến thức về các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hóa học.
Cân bằng sẽ chuyển dịch theo chiều thuận khi tăng áp suất của hệ phản ứng, bởi vì tổng số mol khí trước phản ứng lớn hơn tổng số mol khí sau phản ứng.
Cho biết mối quan hệ giữa các giá trị KC của các phản ứng sau:
(1) \(2S{O_2}(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_3}(g)\)
(2) \(S{O_2}(g) + \frac{1}{2}{O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} S{O_3}(g)\)
(3) \(2S{O_3}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2S{O_2}(g) + {O_2}(g)\)
Đáp án : B
Dựa vào kiến thức về biểu thức hằng số cân bằng
\(\begin{array}{l}{K_{C(1)}} = \frac{{{{{\rm{[}}S{O_3}{\rm{]}}}^2}}}{{{{{\rm{[}}S{O_2}{\rm{]}}}^2}.{\rm{[}}{O_2}{\rm{]}}}}\\{K_{C(2)}} = \frac{{{\rm{[}}S{O_3}{\rm{]}}}}{{{\rm{[}}S{O_2}{\rm{]}}.{{{\rm{[}}{O_2}{\rm{]}}}^{1/2}}}}\\{K_{C(3)}} = \frac{{{{{\rm{[S}}{{\rm{O}}_2}{\rm{]}}}^2}.{\rm{[}}{O_2}{\rm{]}}}}{{{{{\rm{[}}S{O_3}{\rm{]}}}^2}}}\end{array}\)
Ta có: \({K_{C(1)}} = {({K_{C(2)}})^2} = \frac{1}{{{K_{C(3)}}}}\)
Đáp án B đúng
Người ta cho N2 và H2 vào trong bình kín dung tích không đổi và thực hiện phản ứng:
\({N_2}(g) + 3{H_2} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}\)
Sau một thời gian, nồng độ các chất trong bình như sau: [N2] = 2M; [H2] = 3M; [NH3] = 2M. Nồng độ mol/l của N2 và H2 ban đầu lần lượt là:
Đáp án : A
Dựa vào kiến thức về cân bằng hóa học
Gọi nồng độ ban đầu của N2 và H2 là a và b
Ta có: [N2] = [H2]/3 = [NH3]/2
\(a - 2 = \frac{{b - 3}}{3} = \frac{2}{2}\)
a = 3 và b = 6
Đáp án A đúng