[SGK Khoa học tự nhiên Lớp 7 Cánh diều] Chủ đề 3. Phân tử
Hướng dẫn học bài: Chủ đề 3. Phân tử - Môn Khoa học tự nhiên Lớp 7 Lớp 7. Đây là sách giáo khoa nằm trong bộ sách 'SGK Khoa học tự nhiên Lớp 7 Cánh diều Lớp 7' được biên soạn theo chương trình đổi mới của Bộ giáo dục. Hi vọng, với cách hướng dẫn cụ thể và giải chi tiết các bé sẽ nắm bài học tốt hơn.
Bài tập 1
a) Nêu ý nghĩa của công thức hóa học
b) Mỗi công thức hóa học sau đây cho biết những thông tin gì?
Na2CO3, O2, H2SO4, KNO3
Phương pháp giải:
a)
- Công thức hóa học của một chất cho biết 1 số thông tin: nguyên tố tạo ra chất, số nguyên tử mỗi nguyên tố, khối lượng phân tử
- Biết công thức hóa học tính được phần trăm khối lượng các nguyên tố trong hợp chất
- Biết công thức hóa học và hóa trị của một nguyên tố, xác định được hóa trị của nguyên tố còn lại trong hợp chất
b)
- Nguyên tố tạo ra chất
- Số nguyên tử của mỗi nguyên tố
- Khối lượng phân tử
- Phần trăm khối lượng các nguyên tố trong hợp chất
- Hóa trị của nguyên tố, nhóm nguyên tố
Lời giải chi tiết:
a) Ý nghĩa của công thức hóa học là:
- Công thức hóa học của một chất cho biết một số thông tin
+ Nguyên tố tạo ra chất
+ Số nguyên tử của mỗi nguyên tố có trong một phân tử chất
+ Khối lượng phân tử của chất
- Biết công thức hóa học tính được phần trăm khối lượng các nguyên tố trong hợp chất
Bước 1: Tính khối lượng mỗi nguyên tố có trong 1 phân tử hợp chất
Bước 2: Tính khối lượng phân tử
Bước 3: Tính phần trăm khối lượng của nguyên tố theo công thức:

- Biết công thức hóa học và hóa trị của một nguyên tố, xác định được hóa trị của nguyên tố còn lại trong hợp chất
Bước 1: Đặt hóa trị của nguyên tố chưa biết là a
Bước 2: Xác định a dựa vào quy tắc hóa trị
b)
- Na2CO3
+ Các nguyên tố tạo thành: Na, C, O
+ Số nguyên tử của mỗi nguyên tố: 2 nguyên tử của nguyên tố Na, 1 nguyên tử của nguyên tố C, 3 nguyên tử của nguyên tố O
+ Khối lượng phân tử = 2 x 23 amu + 1 x 12 amu + 3 x 16 amu = 106 amu
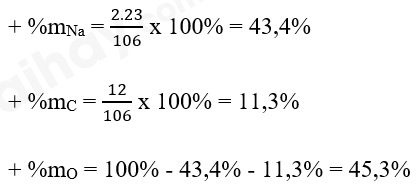
+ Hóa trị: Na hóa trị I, nhóm CO3 hóa trị II
- O2
+ Các nguyên tố tạo thành: O
+ Số nguyên tử của mỗi nguyên tố: 2 nguyên tử của nguyên tố O
+ Khối lượng phân tử = 2 x 16 amu =32 amu
+ Hóa trị: O hóa trị II
- H2SO4
+ Các nguyên tố tạo thành: H, S, O
+ Số nguyên tử của mỗi nguyên tố: 2 nguyên tử của nguyên tố H, 1 nguyên tử của nguyên tố S, 4 nguyên tử của nguyên tố O
+ Khối lượng phân tử = 2 x 1 amu + 1 x 32 amu + 4 x 16 amu = 98 amu

+ Hóa trị: H hóa trị I, nhóm SO4 hóa trị II
- KNO3
+ Các nguyên tố tạo thành: K, N, O
+ Số nguyên tử của mỗi nguyên tố: 1 nguyên tử của nguyên tố K, 1 nguyên tử của nguyên tố N, 3 nguyên tử của nguyên tố O
+ Khối lượng phân tử = 1 x 39 amu + 1 x 14 amu + 3 x 16 amu = 101 amu

+ Hóa trị: K hóa trị I, nhóm NO3 hóa trị I
Bài tập 2
Viết công thức hóa học và tính khối lượng phân tử của các hợp chất sau:
a) Calcium oxide (vôi sống), biết trong phân tử có 1 Ca và 1 O
b) Hydrogen sulfide, biết trong phân tử có 2 H và 1 S
c) Sodium sulfate, biết trong phân tử có 2 Na, 1 S và 4 O
Phương pháp giải:
- Công thức hóa học gồm 2 phần
+ Phần chữ: kí hiệu hóa học của các nguyên tố tạo thành
+ Phần số: ghi dưới chân bên phải của nguyên tố đó, ứng với số nguyên tử của nguyên tố trong 1 phân tử
- Khối lượng phân tử = tổng khối lượng các nguyên tố trong hợp chất
Lời giải chi tiết:
a) Calcium oxide (vôi sống): có 1 Ca và 1 O
=> Công thức hóa học: CaO
=> Khối lượng phân tử: MCaO = 1 x 40 amu + 1 x 16 amu = 56 amu
b) Hydrogen sulfide: có 2 H và 1 S
=> Công thức hóa học: H2S
=> Khối lượng phân tử: MH2S = 2 x 1 amu + 1 x 32 amu = 34 amu
c) Sodium sulfate: có 2 Na, 1 S và 4 O
=> Công thức hóa học: Na2SO4
=> Khối lượng phân tử: MNa2SO4 = 2 x 23 amu + 1 x 32 amu + 4 x 16 amu = 119 amu
Bài tập 3
Cho công thức hóa học của một số chất như sau:
(1) F2
(2) LiCl
(3) Cl2
(4) MgO
(5) HCl
Trong các công thức trên, công thức nào là của đơn chất, công thức nào là của hợp chất?
Phương pháp giải:
- Đơn chất là những chất được tạo thành từ 1 nguyên tố hóa học
- Hợp chất là những chất do 2 hoặc nhiều nguyên tố hóa học tạo thành
Lời giải chi tiết:
(1) F2: Do 1 nguyên tố F tạo thành => Đơn chất
(2) LiCl: Do 2 nguyên tố là Li và Cl tạo thành => Hợp chất
(3) Cl2: Do 1 nguyên tố Cl tạo thành => Đơn chất
(4) MgO: Do 2 nguyên tố là Mg và O tạo thành => Hợp chất
(5) HCl: Do 2 nguyên tố là H và Cl tạo thành => Hợp chất
Bài tập 4
Một số chất có công thức hóa học như sau: BaSO4, Cu(OH)2, ZnSO4
Dựa vào bảng 6.2, tính hóa trị của các nguyên tố Ba, Cu, Zn trong các hợp chất trên.

Phương pháp giải:
- Đặt hóa trị của nguyên tố chưa biết là a
- Xác định a dựa vào quy tắc hóa trị: => a.x = b.y (trong đó a, b lần lượt là hóa trị của A và B)
Lời giải chi tiết:
- Xét công thức hóa học: BaSO4
+ Gọi hóa trị của Ba trong hợp chất là a
+ Vì SO4 có hóa trị II nên ta có biểu thức:
a x 1 = II x 1 => a = II
=> Ba có hóa trị II trong hợp chất BaSO4
- Xét công thức hóa học: Cu(OH)2
+ Gọi hóa trị của Cu trong hợp chất là a
+ Vì OH có hóa trị I nên ta có biểu thức:
a x 1 = I x 2 => a = II
=> Cu có hóa trị II trong hợp chất Cu(OH)2
- Xét công thức hóa học: ZnSO4
+ Gọi hóa trị của Zn trong hợp chất là a
+ Vì SO4 có hóa trị II nên ta có biểu thức:
a x 1 = II x 1 => a = II
=> Zn có hóa trị II trong hợp chất ZnSO4
Bài tập 5
Hãy lập công thức hóa học của những chất tạo thành từ các nguyên tố:
a) C và S
b) Mg và S
c) Al và Br
Biết hóa trị của các nguyên tố như sau:
Nguyên tố
C
S
Mg
Al
Br
Hóa trị
IV
II
II
III
I
Phương pháp giải:
- Đặt công thức hóa học của hợp chất \(A_x^aB_y^b\) (trong đó a, b lần lượt là hóa trị của A và B)
- Áp dụng quy tắc hóa trị:
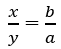
- Xác định x, y (x, y thường là những số nguyên nhỏ nhất thỏa mãn tỉ lệ trên)
Lời giải chi tiết:
a) C và S

b) Mg và S

c) Al và Br

Bài tập 6
Các hợp chất của calcium có nhiều ứng dụng trong đời sống:
- CaSO4 là thành phần chính của thạch cao. Thạch cao được dùng để đúc tượng, sản xuất các vật liệu xây dựng…
- CaCO3 là thành phần chính của đá vôi. Đá vôi được dùng nhiều trong công nghiệp sản xuất xi măng
- CaCl2 được dùng để hút ẩm, chống đóng băng tuyết trên mặt đường ở xứ lạnh
Hãy tính phần trăm khối lượng của calcium trong các hợp chất trên
Phương pháp giải:
- Tính khối lượng mỗi nguyên tố có trong một phân tử hợp chất
- Tính khối lượng phân tử
- Tính phần trăm khối lượng của nguyên tố theo công thức:

Lời giải chi tiết:
- Xét hợp chất CaSO4
Khối lượng nguyên tố Ca trong CaSO4 là: mCa = 1 x 40 amu = 40 amu
Khối lượng phân tử CaSO4: MCaSO4 = 1 x 40 amu + 1 x 32 amu + 4 x 16 amu = 136 amu
Phần trăm về khối lượng của Ca trong hợp chất CaSO4 là:
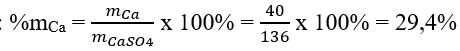
- Xét hợp chất CaCO3
Khối lượng nguyên tố Ca trong CaCO3 là: mCa = 1 x 40 amu = 40 amu
Khối lượng phân tử CaCO3: MCaCO3 = 1 x 40 amu + 1 x 12 amu + 3 x 16 amu = 100 amu
Phần trăm về khối lượng của Ca trong hợp chất CaCO3 là:
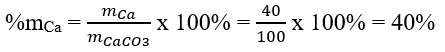
- Xét hợp chất CaCl2
Khối lượng nguyên tố Ca trong CaCl2 là: mCa = 1 x 40 amu = 40 amu
Khối lượng phân tử CaCl2: MCaCl2 = 1 x 40 amu + 2 x 35,5 amu = 111 amu
Phần trăm về khối lượng của Ca trong hợp chất CaCl2 là:
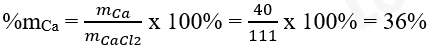
Bài tập 7
Copper(II) sulfate có trong thành phần của một số thuốc diệt nấm, trừ sâu và diệt cỏ cho cây trồng. Copper(II) sulfate được tạo thành từ các nguyên tố Cu, S, O và có khối lượng phân tử là 160 amu. Phần trăm khối lượng của các nguyên tố Cu, S và O trong copper(II) sulfate lần lượt là: 40%, 20%, 40%. Hãy xác định công thức hóa học của copper(II) sulfate
Phương pháp giải:
- Đặt công thức hóa học của chất là CuxSyOz
- Tính khối lượng của Cu, S, O trong 1 phân tử chất
- Tính x, y, z
Lời giải chi tiết:
Đặt công thức hóa học của copper(II) sulfate là CuxSyOz

Ta có: 64 amu . x = 64 amu => x = 1
32 amu . y = 32 amu => y = 1
16 amu . z = 64 amu => z = 4
Vậy công thức hóa học của copper(II) sulfate là: CuSO4
CH tr 39 MĐ
Cho các miếng bìa ghi kí hiệu hóa học của các nguyên tố C, O, Cl, H như hình dưới đây. Mỗi miếng bìa tượng trưng cho một nguyên tử. Hãy ghép các miếng bìa H với các miếng bìa khác sao cho phù hợp.
Hãy cho biết mỗi nguyên tử C, O, Cl ghép được với tối đa bao nhiêu nguyên tử H. Dùng kí hiệu hóa học và các chữ số để mô tả trong những miếng ghép thu được có bao nhiêu nguyên tử của mỗi nguyên tố

Lời giải chi tiết:
- 1 nguyên tử C ghép được tối đa 4 nguyên tử H => CH4
- 1 nguyên tử O ghép được tối đa 2 nguyên tử H => H2O
- 1 nguyên tử Cl ghép được tối đa 1 nguyên tử H => HCl
CH tr 39 CH
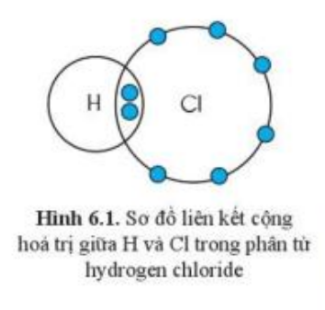
Quan sát hình 6.1, hãy so sánh hóa trị của nguyên tố và số electron mà nguyên tử của nguyên tố đã góp chung để tạo ra liên kết
Phương pháp giải:
H và Cl đều có hóa trị I
Lời giải chi tiết:
- Trong hình 6.1, mỗi nguyên tử H và Cl góp 1 electron tạo ra đôi electron dùng chung giữa 2 nguyên tử
- H và Cl đều có hóa trị I
=> Hóa trị của nguyên tố = số electron mà nguyên tử của nguyên tố đã góp chung để tạo ra liên kết
CH tr 40 LT
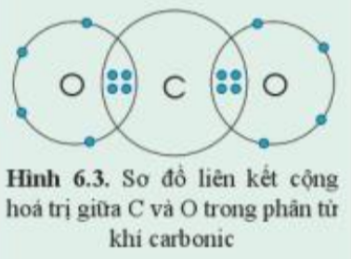
Quan sát hình 6.3 và xác định hóa trị của C và O trong khí carbonic
Phương pháp giải:
Hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác
Lời giải chi tiết:
- Mỗi nguyên tử O góp chung 2 electron
- Nguyên tử C góp chung 4 electron
=> Nguyên tử C liên kết với 2 nguyên tử O bằng 4 cặp đôi electron chung
=> C có hóa trị IV và O có hóa trị II
CH tr 40 LT
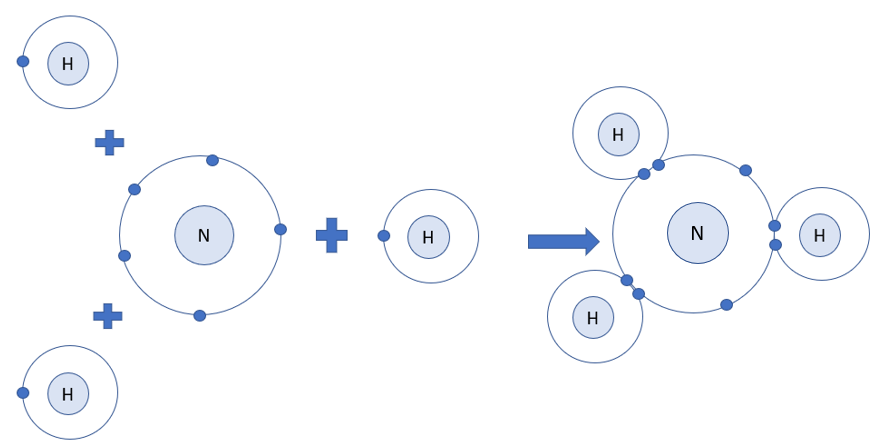
Vẽ sơ đồ hình thành liên kết giữa nguyên tử N và ba nguyên tử H. Hãy cho biết liên kết đó thuộc loại liên kết nào. Hóa trị của mỗi nguyên tố trong hợp chất tạo thành là bao nhiêu?
Phương pháp giải:
- Nguyên tử N có 5 electron ở lớp ngoài cùng => Cần thêm 3 electron để đạt cấu hình electron của khí hiếm Ne
- Nguyên tử H có 1 electron ở lớp ngoài cùng => Cần nhận thêm 1 electron để đạt cấu hình electron của khí hiếm He
- Trong hợp chất cộng hóa trị, hóa trị của nguyên tố = số electron mà nguyên tử nguyên tố đó góp chung với nguyên tử khác
Lời giải chi tiết:
- Nguyên tử N có 5 electron ở lớp ngoài cùng => Cần thêm 3 electron để đạt cấu hình electron của khí hiếm Ne
- Nguyên tử H có 1 electron ở lớp ngoài cùng => Cần nhận thêm 1 electron để đạt cấu hình electron của khí hiếm He
=> Khi 3 nguyên tử H và 1 nguyên tử N liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử N góp ra 3 electron để tạo ra 3 đôi electron dùng chung
=> Sơ đồ tạo thành phân tử hydrogen chloride từ nguyên tử H và N:
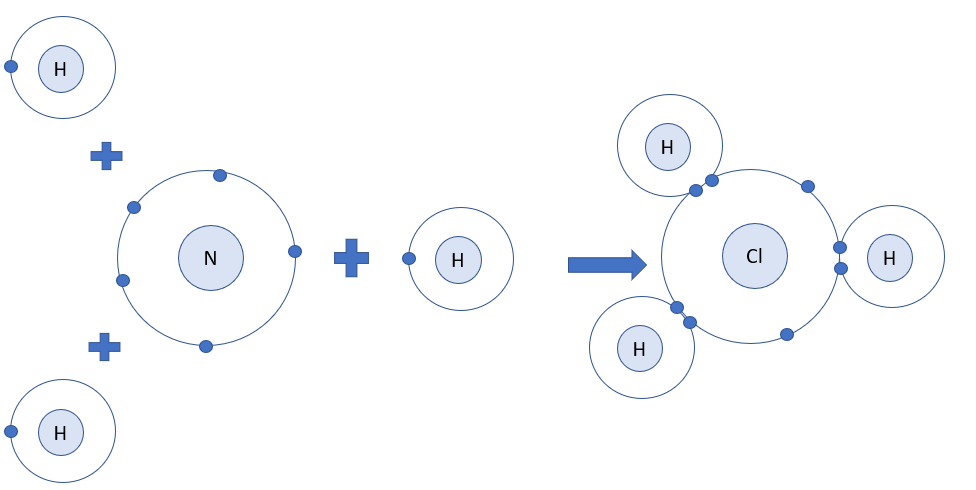
=> Hợp chất NH3 là liên kết cộng hóa trị
- Mỗi nguyên tử H góp chung 1 electron, nguyên tử N góp chung 3 electron
=> H có hóa trị I, N có hóa trị III
CH tr 41 CH
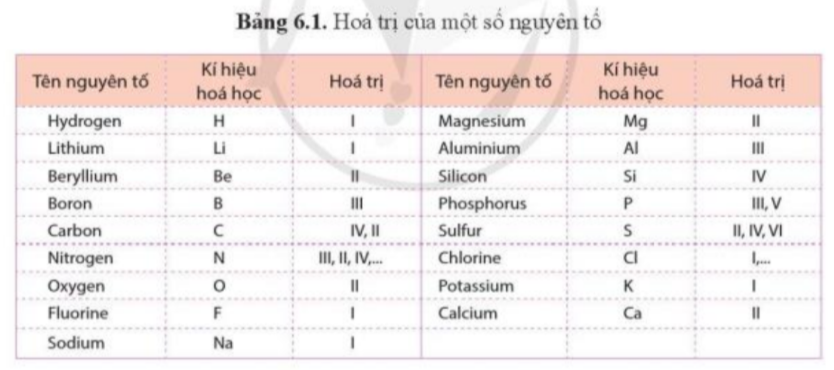
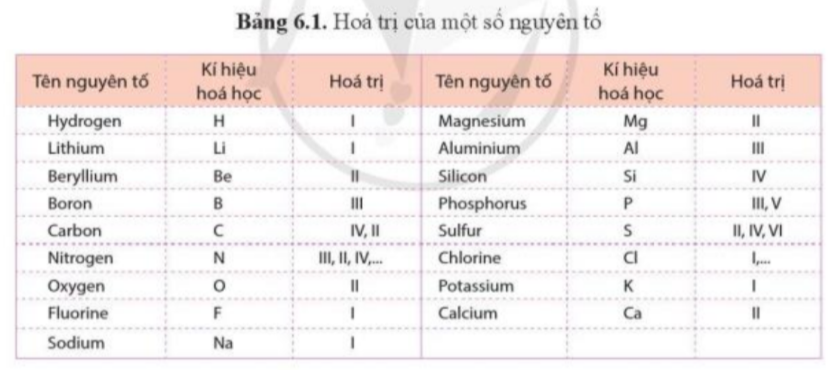
Cát được sử dụng nhiều trong xây dựng và là nguyên liệu chính để sản xuất thủy tinh. Silicon oxide là thành phần chính của cát. Phân tử silicon oxide gồm 1 nguyên tử Si liên kết với 2 nguyên tử O. Dựa vào hóa trị của các nguyên tố trong bảng 6.1, hãy tính tích hóa trị và số nguyên tử của mỗi nguyên tố trong phân tử silicon oxide và nhận xét về tích đó.
Phương pháp giải:
Quy tắc hóa trị: Khi các nguyên tử của 2 nguyên tố A, B liên kết với nhau, tích giữa hóa trị và số nguyên tử của A bằng tích giữa hóa trị và số nguyên tử của B
Lời giải chi tiết:
Nguyên tố
Si
O
Hóa trị
IV
II
Số nguyên tử
1
2
Tích hóa trị và số nguyên tử
IV x 1 = II x 2
=> Tích hóa trị và số nguyên tử của nguyên tố Si = tích hóa trị và số nguyên tử của nguyên tố O
CH tr 41 LT
1. Dựa vào hóa trị của các nguyên tố trong bảng 6.1 và quy tắc hóa trị, hãy cho biết mỗi nguyên tử Mg có thể kết hợp được với bao nhiêu nguyên tử Cl.
2. Nguyên tố A có hóa trị III, nguyên tố B có hóa trị II. Hãy tính tỉ lệ nguyên tử của A và B trong hợp chất tạo thành từ 2 nguyên tố đó.
Phương pháp giải:
1.
Quy tắc hóa trị: Khi các nguyên tử của 2 nguyên tố A, B liên kết với nhau, tích giữa hóa trị và số nguyên tử của A bằng tích giữa hóa trị và số nguyên tử của B
2.
Bước 1: Gọi số nguyên tử của nguyên tố A, B lần lượt là x và y
Bước 2: Áp dụng quy tắc hóa trị
Bước 3: Tính tỉ lệ
Lời giải chi tiết:
1.
- Gọi số nguyên tử của nguyên tố Mg (II), Cl (I) lần lượt là x và y
- Áp dụng quy tắc hóa trị ta có: II.x = I.y

2.
- Gọi số nguyên tử của nguyên tố A (III), B (II) lần lượt là x và y

CH tr 41 CH
Cho công thức hóa học của một số chất như sau:
a) N2 (nitrogen)
b) NaCl (sodium chloride)
c) MgSO4 (magnesium sulfate)
Xác định nguyên tố tạo thành mỗi chất và số nguyên tử của mỗi nguyên tố có trong phân tử
Phương pháp giải:

- Công thức hóa học gồm 2 phần:
+ Phần chữ: kí hiệu hóa học của các nguyên tố tạo thành chất
+ Phần số: số được ghi dưới chân kí hiệu hóa học, ứng với số nguyên tử của nguyên tố trong 1 phân tử
Lời giải chi tiết:
a) N2: Nguyên tố tạo thành là N, có 2 nguyên tử N
b) NaCl gồm:
+ Nguyên tố Na, có 1 nguyên tử Na
+ Nguyên tố Cl, có 1 nguyên tử Cl
c) MgSO4 gồm:
+ Nguyên tố Mg, có 1 nguyên tử Mg
+ Nguyên tố S, có 1 nguyên tử S
+ Nguyên tố O, có 4 nguyên tử O
CH tr 42 LT
Viết công thức hóa học của các chất:
a) Sodium sulfide, biết trong phân tử có 2 nguyên tử Na và 1 nguyên tử S
b) Phosphoric acid, biết trong phân tử có 3 nguyên tử H, 1 nguyên tử P và 4 nguyên tử O
Phương pháp giải:
- Phần chữ: kí hiệu hóa học của các nguyên tố tạo thành chất
- Phần số: số được ghi dưới chân (bên phải) kí hiệu hóa học, ứng với số nguyên tử của nguyên tố trong 1 phân tử
Lời giải chi tiết:
a) Sodium sulfide: 2 nguyên tử Na, 1 nguyên tử S
=> Na2S
b) Phosphoric acid: 3 nguyên tử H, 1 nguyên tử P, 4 nguyên tử O
=> H3PO4
CH tr 42 LT
Viết công thức hóa học cho các chất được biểu diễn bằng những mô hình sau. Biết mỗi quả cầu biểu diễn cho 1 nguyên tử
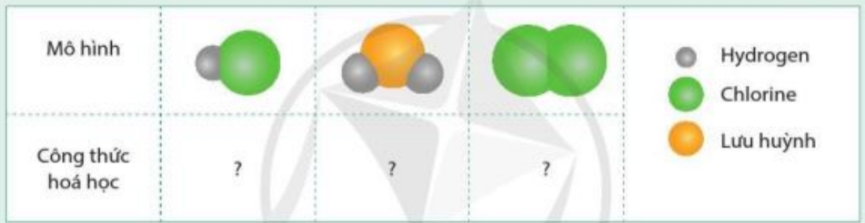
Phương pháp giải:
- Phần chữ: kí hiệu hóa học của các nguyên tố tạo thành chất
- Phần số: số được ghi dưới chân (bên phải) kí hiệu hóa học, ứng với số nguyên tử của nguyên tố trong 1 phân tử
+ Hydrogen: H
+ Chlorine: Cl
+ Lưu huỳnh: S
Lời giải chi tiết:
- Mô hình 1: 1 nguyên tử H, 1 nguyên tử Cl => HCl
- Mô hình 2: 2 nguyên tử H, 1 nguyên tử S => H2S
- Mô hình 3: 2 nguyên tử Cl => Cl2
CH tr 42 LT
Đường glucose là nguồn cung cấp năng lượng quan trọng cho hoạt động sống của con người. Đường glucose có công thức hóa học là C6H12O6.
Hãy cho biết:
a) Glucose được tạo thành từ những nguyên tố nào?
b) Khối lượng mỗi nguyên tố trong 1 phân tử glucose là bao nhiêu?
c) Khối lượng phân tử glucose là bao nhiêu?
Phương pháp giải:
a) Phần chữ của công thức hóa học: kí hiệu hóa học của các nguyên tố tạo thành chất
b) Khối lượng mỗi nguyên tố = khối lượng nguyên tử x chỉ số của nguyên tố đó
c) Khối lượng phân tử = tổng khối lượng của các nguyên tố tạo nên phân tử
Lời giải chi tiết:
a) Glucose được tạo thành từ những nguyên tố: C, H và O
b)
- Nguyên tố C: Có 6 nguyên tử C (khối lượng nguyên tử: 12 amu)
=> Khối lượng nguyên tố C trong 1 phân tử glucose = 12 amu x 6 = 72 amu
- Nguyên tố H: Có 12 nguyên tử H (khối lượng nguyên tử: 1 amu)
=> Khối lượng nguyên tố H trong 1 phân tử glucose = 1 amu x 12 = 12 amu
- Nguyên tố O: Có 6 nguyên tử O (khối lượng nguyên tử: 16 amu)
=> Khối lượng nguyên tố O trong 1 phân tử glucose = 16 amu x 6 = 96 amu
c)
Khối lượng phân tử glucose = khối lượng nguyên tố C + khối lượng nguyên tố H + khối lượng nguyên tố O
= 72 amu + 12 amu + 96 amu = 180 amu
CH tr 43 CH
Có ý kiến cho rằng: Trong nước, số nguyên tử H gấp 2 lần số nguyên tử O nên phần trăm khối lượng của H trong nước gấp 2 lần phần trăm khối lượng O. Theo em, ý kiến trên có đúng không? Hãy tính phần trăm khối lượng của H, O trong nước để chứng minh
Phương pháp giải:
Bước 1: Tính khối lượng mỗi nguyên tố có trong 1 phân tử hợp chất
Bước 2: Tính khối lượng phân tử
Bước 3: Tính phần trăm khối lượng của nguyên tố theo công thức:

Lời giải chi tiết:
Trong phân tử nước gồm: 1 nguyên tử O và 2 nguyên tử H
Ta có: Khối lượng của nguyên tố O trong nước là:
mO = 1 x 16 amu = 16 amu
Khối lượng của nguyên tố H trong nước là:
mH = 2 x 1 amu = 2 amu
=> Khối lượng phân tử nước là: Mnước = 16 + 2 = 18 amu

=> Ý kiến: Phần trăm khối lượng của H trong nước gấp 2 lần phần trăm khối lượng O là sai
CH tr 43 LT
1. Calcium carbonate là thành phần chính của đá vôi, có công thức hóa học là CaCO3. Tính phần trăm khối lượng của mỗi nguyên tố trong hợp chất trên
2. Citric acid là hợp chất được sử dụng nhiều trong công nghiệp thực phẩm, dược phẩm. Trong tự nhiên, citric acid có trong quả chanh và một số loại quả như bưởi, cam,… Citric acid có công thức hóa học là C6H8O7. Hãy tính phần trăm khối lượng của mỗi nguyên tố trong citric acid
Phương pháp giải:
Bước 1: Tính khối lượng mỗi nguyên tố có trong 1 phân tử hợp chất
Bước 2: Tính khối lượng phân tử
Bước 3: Tính phần trăm khối lượng của nguyên tố theo công thức:

Lời giải chi tiết:
1. Calcicum carbonate gồm: 1 nguyên tử Ca, 1 nguyên tử C và 3 nguyên tử O
Ta có: Khối lượng của nguyên tố Ca trong CaCO3 là:
mCa = 1 x 40 amu = 40 amu
Khối lượng của nguyên tố C trong CaCO3 là:
mC = 1 x 12 amu = 12 amu
Khối lượng của nguyên tố O trong CaCO3 là:
mO = 3 x 16 amu = 48 amu
=> Khối lượng phân tử CaCO3 là: MCaCO3 = 40 + 12 + 48 = 100 amu

2. Citric acid gồm: 6 nguyên tử C, 8 nguyên tử H và 7 nguyên tử O
Ta có: Khối lượng của nguyên tố C trong C6H8O7 là:
mC = 6 x 12 amu = 72 amu
Khối lượng của nguyên tố H trong C6H8O7 là:
mH = 1 x 8 amu = 8 amu
Khối lượng của nguyên tố O trong C6H8O7 là:
mO = 7 x 16 amu = 112 amu
=> Khối lượng phân tử C6H8O7 là: MC6H8O7 = 72 + 8 + 112 = 192 amu

CH tr 43 VD
Potassium rất cần thiết cho cây trồng, đặc biệt trong giai đoạn cây trưởng thành, ra hoa, kết trái. Để cung cấp K cho cây có thể sử dụng phân potassium chloride và potassium sulfate có công thức hóa học lần lượt là KCl và K2SO4. Người trồng cây muốn sử dụng loại phân bón có hàm lượng K cao hơn thì nên chọn loại phân bón nào?
Phương pháp giải:
Tính phần trăm của K trong 2 hợp chất là KCl và K2SO4
Bước 1: Tính khối lượng nguyên tố K có trong 1 phân tử hợp chất
Bước 2: Tính khối lượng phân tử
Bước 3: Tính phần trăm khối lượng của nguyên tố theo công thức:

Lời giải chi tiết:
- Xét hợp chất KCl:
Ta có: Khối lượng của nguyên tố K trong KCl là:
mK = 1 x 39 amu = 39 amu
Khối lượng phân tử KCl là: MKCl = 1 x 39 amu + 1 x 35,5 amu = 74,5 amu
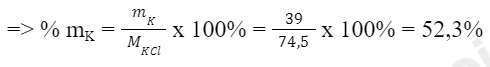
- Xét hợp chất K2SO4:
Ta có: Khối lượng của nguyên tố K trong K2SO4 là:
mK = 2 x 39 amu = 78 amu
Khối lượng phân tử K2SO4 là: MK2SO4 = 2 x 39 amu + 1 x 32 amu + 4 x 16 amu = 174 amu
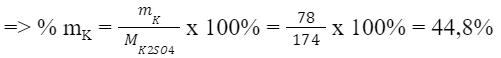
=> Hàm lượng K trong KCl nhiều hơn trong K2SO4
=> Người trồng muốn sử dụng loại phân bón có hàm lượng K cao hơn thì nên chọn phân bón potassium sulfate
CH tr 44 LT
Xác định hóa trị của mỗi nguyên tố trong các hợp chất sau: HBr, BaO
Phương pháp giải:
Bước 1: Đặt hóa trị của nguyên tố chưa biết là a
Bước 2: Xác định a dựa vào quy tắc hóa trị
Lời giải chi tiết:
- Xét hợp chất HBr:
+ Gọi hóa trị của Br trong hợp chất là a
+ Vì H có hóa trị I nên ta có biểu thức:
a x 1 = I x 1 => a = I
=> Vậy H có hóa trị I và Br có hóa trị I
- Xét hợp chất BaO
+ Gọi hóa trị của Ba trong hợp chất là a
+ Vì O có hóa trị II nên ta có biểu thức:
a x 1 = II x 1 => a = II
=> Vậy O có hóa trị II và Ba có hóa trị II
CH tr 45 LT
Hợp chất X được tạo thành bởi Fe và O có khối lượng phân tử là 160. Biết phần trăm khối lượng của Fe trong X là 70%. Hãy xác định công thức hóa học của X
Phương pháp giải:
Bước 1: Đặt công thức hóa học của chất là FexOy
Bước 2: Tính khối lượng của Fe và O trong 1 phân tử chất
Bước 3: Tìm x, y
Lời giải chi tiết:
Đặt công thức hóa học của X là FexOy
Khối lượng của nguyên tố Fe trong 1 phân tử X là:

Khối lượng của nguyên tố O trong 1 phân tử X là:
160 – 112 = 48 amu
Ta có: 56 amu . x = 112 amu => x = 2
16 amu . y = 48 amu => y = 3
Vậy công thức hóa học của X là Fe2O3
CH tr 33 MĐ
Trong điều kiện thường, nguyên tử của các nguyên tố khí hiếm tồn tại độc lập vì có lớp electron ngoài cùng bền vững. Nguyên tử của các nguyên tố khác luôn có xu hướng tham gia liên kết để có được lớp electron ngoài cùng bền vững tương tự khí hiếm. Vậy liên kết giữa các nguyên tử được hình thành như thế nào?
Lời giải chi tiết:
- Liên kết giữa các nguyên tử được hình thành nhờ vào sự góp chung electron, nhường electron hoặc nhận electron để đạt cấu hình electron bền vững của khí hiếm
CH tr 33 CH
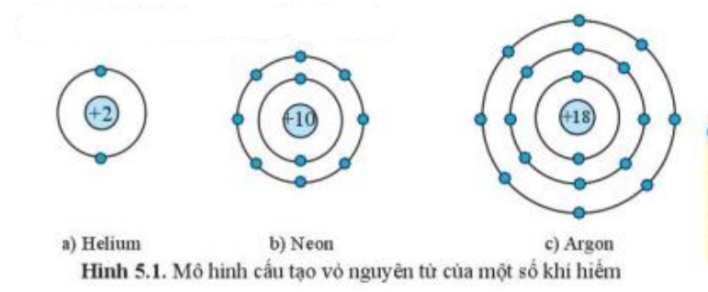
Quan sát hình 5.1, hãy cho biết số electron ở lớp ngoài cùng của vỏ nguyên tử khí hiếm
Phương pháp giải:
Quan sát hình 5.1, đếm số quả cầu màu xanh ở đường tròn ngoài cùng
Lời giải chi tiết:
- Xét nguyên tử helium: có 2 electron ở lớp ngoài cùng
- Xét nguyên tử neon: có 8 electron ở lớp ngoài cùng
- Xét nguyên tử argon: có 8 electron ở lớp ngoài cùng
CH tr 34 Tìm hiểu thêm
Helium được phát hiện vào năm 1868, khi các nhà khoa học nhận thấy một nguyên tố chưa được biết đến trong quang phổ ánh sáng từ Mặt Trời. Helium được đặt theo tên của thần Mặt Trời – Helios (theo tiếng Hy Lạp). Tuy nhiên, phải thới năm 1895, các nhà khoa học mới thu được helium trong quá trình xử lí quặng uranium. Mặc dù trong vũ trụ, helium là khí phổ biến thứ hai sau khí hydrogen, nhưng trên Trái Đất khí helium tương đối hiếm. Hãy tìm hiểu một số ứng dụng của helium trong thực tiễn
Phương pháp giải:
Học sinh tìm hiểu qua sách, báo, tivi, internet…
Lời giải chi tiết:
- Ứng dụng của helium trong hàn luyện kim: bảo vệ các mối hàn tốt, tránh tình trạng oxy hóa, han gỉ
- Kiểm tra rò rỉ trên hệ thống điều hòa xe hơi, tàu thuyền
- Bơm bóng bay
- Làm sạch bồn chứa
- Hỗ trợ điều trị hen suyễn, vận hành của máy chụp cộng hưởng tử MRI
- Làm chất bán dẫn: làm mát do độ dẫn nhiệt và nhiệt riêng rất cao
- Trong lò phản ứng hạt nhân làm môi trường truyền nhiệt
- Làm thay đổi giọng nói
CH tr 34 CH
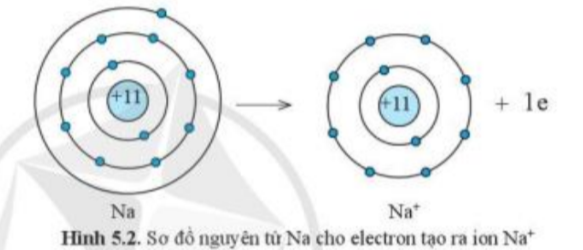
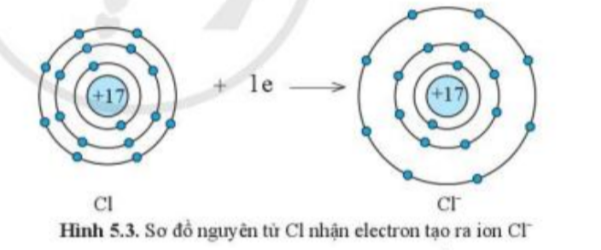
1. Quan sát hình 5.2 và hình 5.3, cho biết lớp vỏ của các ion Na+, Cl- tương tự vỏ nguyên tử của nguyên tố khí hiếm nào.
2. Quan sát hình 5.2, hãy so sánh về số electron, số lớp electron giữa nguyên tử Na và ion Na+
Phương pháp giải:
1. Đếm số electron ở lớp vỏ và số lớp electron của ion Na+, Cl-
2. Đếm số electron và số lớp electron của nguyên tử Na, ion Na+
Lời giải chi tiết:
1.
- Xét ion Na+:
+ Có 10 hình cầu màu xanh ở các đường tròn => Có 10 electron ở lớp vỏ
+ Có 2 đường tròn xung quanh hạt nhân => Có 2 lớp electron
=> Lớp vỏ ion Na+ tương tự vỏ nguyên tử của nguyên tố khí hiếm Ne
- Xét ion Cl-
+ Có 18 hình cầu màu xanh ở các đường tròn => Có 18 electron ở lớp vỏ
+ Có 3 đường tròn xung quanh hạt nhân => Có 3 lớp electron
=> Lớp vỏ ion Cl- tương tự vỏ nguyên tử của nguyên tố khí hiếm Ar
2.
- Nguyên tử Na có 11 electron và 3 lớp electron
- Ion Na+ có 10 electron và 2 lớp electron
=> Nguyên tử Na đã mất đi 1 electron để tạo thành ion Na+
CH tr 35 LT
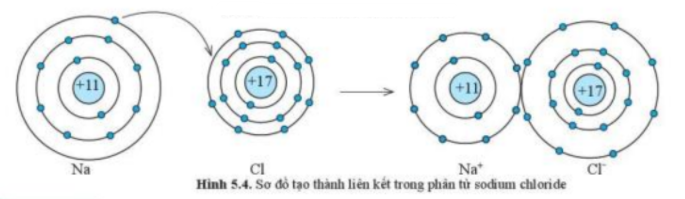
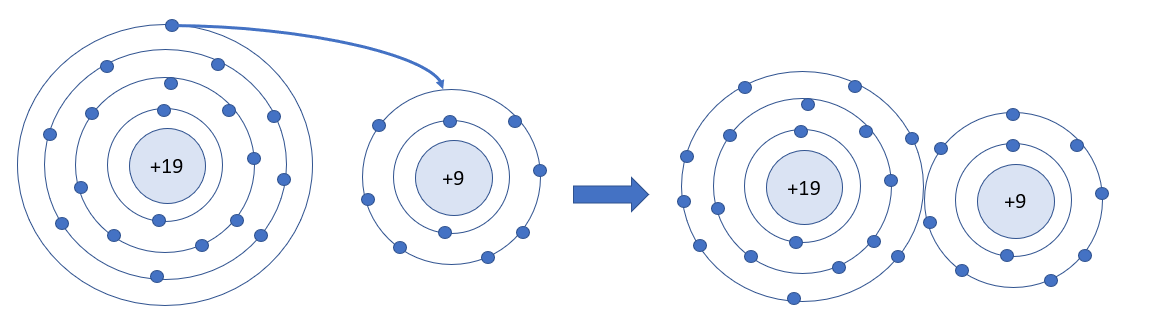
Số electron ở lớp ngoài cùng của nguyên tử K và F lần lượt là 1 và 7. Hãy cho biết khi K hết hợp với F để tạo thành phân tử potassium fluoride, nguyên tử K cho hay nhận bao nhiêu electron. Vẽ sơ đồ tạo thành liên kết trong phân tử potassium fluoride
Phương pháp giải:
- K có 1 electron ở lớp ngoài cùng => Tương tự nguyên tử Na
- F có 7 electron ở lớp ngoài cùng => Tương tự nguyên tử Cl
- Vẽ sơ đồ tạo thành liên kết: Tương tự hình 5.4
Lời giải chi tiết:
- Khi K liên kết với F tạo thành phân tử potassium fluoride sẽ diễn ra sự cho và nhận electron giữa 2 nguyên tử. Với nguyên tử K có 1 electron ở lớp ngoài cùng => Cho đi 1 electron ở lớp ngoài cùng để đạt cấu hình electron bền vững của khí hiếm
- Sơ đồ tạo thành liên kết trong phân tử potassium fluoride:
CH tr 35 CH
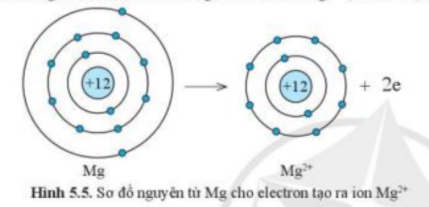
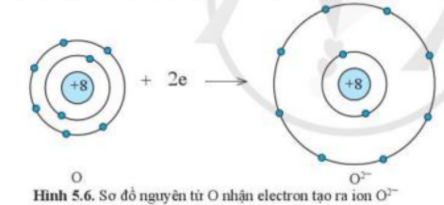
1. Quan sát các hình 5.5 và 5.6, cho biết các ion Mg2+ và O2- có lớp vỏ tương tự khí hiếm nào
2. Quan sát hình 5.5, hãy so sánh về số electron, số lớp electron giữa nguyên tử Mg và ion Mg2+
Phương pháp giải:
1. Đếm số electron ở lớp vỏ và số lớp electron của ion Mg2+, O2-
2. Đếm số electron và số lớp electron của nguyên tử Mg, ion Mg2+
Lời giải chi tiết:
1.
- Xét ion Mg2+:
+ Có 10 hình cầu màu xanh ở các đường => Có 10 electron ở lớp vỏ
+ Có 2 đường tròn xung quanh hạt nhân => Có 2 lớp electron
=> Lớp vỏ ion Mg2+ tương tự vỏ nguyên tử của nguyên tố khí hiếm Ne
- Xét ion O2-
+ Có 10 hình cầu màu xanh ở các đường tròn => Có 10 electron ở lớp vỏ
+ Có 2 đường tròn xung quanh hạt nhân => Có 2 lớp electron
=> Lớp vỏ ion O2- tương tự vỏ nguyên tử của nguyên tố khí hiếm Ne
2.
- Nguyên tử Mg có 12 electron và 3 lớp electron
- Ion Mg2+ có 10 electron và 2 lớp electron
=> Nguyên tử Na đã mất đi 2 electron để tạo thành ion Mg2+
CH tr 35 LT
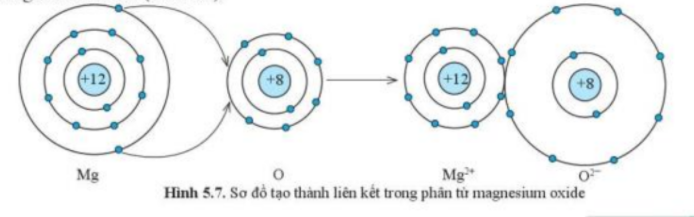
Nguyên tử Ca có 2 electron ở lớp ngoài cùng. Hãy vẽ sơ đồ tạo thành liên kết khi nguyên tử Ca kết hợp với nguyên tử O tạo ra phân tử calcium oxide
Phương pháp giải:
- Ca có 2 electron ở lớp ngoài cùng => Tương tự nguyên tử Mg
- O có 6 electron ở lớp ngoài cùng
- Vẽ sơ đồ tạo thành liên kết: Tương tự hình 5.7
Lời giải chi tiết:
- Ca có 2 electron ở lớp ngoài cùng (giống như nguyên tử Mg) => Dễ dàng cho đi 2 electron ở lớp ngoài cùng để tạo cấu hình electron bền vững của khí hiếm
- O có 6 electron ở lớp ngoài cùng => Dễ dàng nhận thêm 2 electron ở lớp ngoài cùng để tạo cấu hình electron bền vững của khí hiếm
- Sơ đồ tạo thành liên kết khi nguyên tử Ca kết hợp với nguyên tử O tạo ra phân tử calcium oxide:
CH tr 36 LT
Nguyên tử K kết hợp với nguyên tử Cl tạo thành phân tử potassium chloride. Theo em, ở điều kiện thường, potassium chloride là chất rắn, chất lỏng hay chất khí? Vì sao?
Phương pháp giải:
- Phân tử potassium chloride được hình thành nhờ liên kết ion giữa K+ và Cl-
- Tìm hiểu tính chất chung của hợp chất ion
Lời giải chi tiết:
- Phân tử potassium chloride là hợp chất ion được tạo bởi kim loại điển hình (K) và phi kim điển hình (Cl)
- Mà hợp chất ion có những tính chất chung sau:
+ Là chất rắn ở điều kiện thường
+ Thường có nhiệt độ nóng chảy và nhiệt độ sôi cao
+ Khi tan trong nước tạo ra dung dịch dẫn được điện
=> Ở điều kiện thường, potassium chloride là chất rắn
CH tr 36 CH
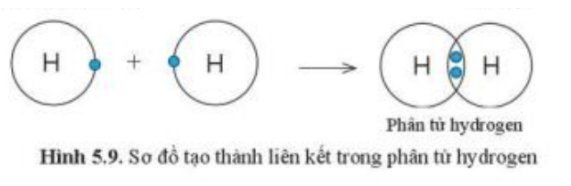
Quan sát hình 5.9, hãy cho biết nguyên tử H trong phân tử hydrogen có lớp vỏ tương tự khí hiếm nào
Phương pháp giải:
Đếm số electron ở lớp vỏ và số lớp electron của nguyên tử H trong phân tử hydrogen
Lời giải chi tiết:
Trong phân tử hydrogen, nguyên tử H có:
+ 2 quả cầu màu xanh ở đường tròn => Có 2 electron ở lớp vỏ
+ 1 đường tròn xung quanh hạt nhân => Có 1 lớp electron
=> Trong phân tử hydrogen, nguyên tử H có lớp vỏ tương tự khí hiếm He
CH tr 36 LT
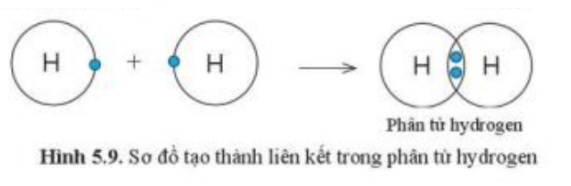
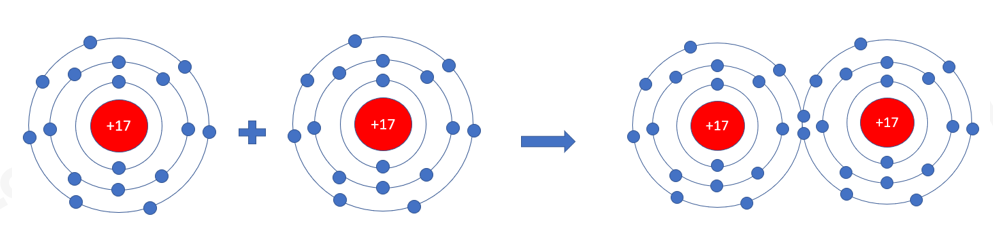
Hai nguyên tử Cl liên kết với nhau tạo thành phân tử chlorine
a) Mỗi nguyên tử Cl cần thêm bao nhiêu electron vào lớp ngoài cùng để có lớp vỏ tương tự khí hiếm
b) Hãy vẽ sơ đồ tạo thành liên kết trong phân tử chlorine
Phương pháp giải:
- Nguyên tử Cl có 7 electron ở lớp ngoài cùng => Cần nhận thêm 1 electron để đạt cấu hình electron bền vững của khí hiếm
=> Mỗi nguyên tử Cl sẽ bỏ ra 1 electron để góp chung (tương tự nguyên tử H trong phân tử hydrogen)
Lời giải chi tiết:
a)
Vì mỗi nguyên tử Cl đều có 7 electron ở lớp vỏ ngoài cùng => Cần nhận thêm 1 electron vào lớp vỏ ngoài cùng để có lớp vỏ tương tự khí hiếm
b)
- Vì mỗi nguyên tử Cl đều cần nhận thêm 1 electron
=> Khi 2 nguyên tử Cl liên kết với nhau, mỗi nguyên tử sẽ góp 1 electron ở tạo ra đôi electron dùng chung
CH tr 37 CH
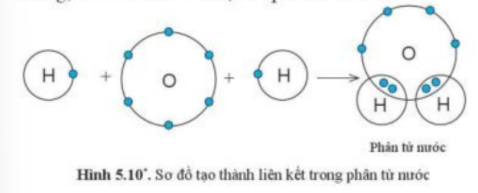
Quan sát hình 5.10, cho biết trong phân tử nước, mỗi nguyên tử H và O có bao nhiêu electron ở lớp ngoài cùng
Phương pháp giải:
Đếm số quả cầu ở lớp ngoài cùng của nguyên tử H và O trong phân tử nước
Lời giải chi tiết:
- Trong phân tử nước:
+ Nguyên tử H có 2 quả cầu màu xanh => Có 2 electron ở lớp ngoài cùng
+ Nguyên tử O có 8 quả cầu màu xanh => Có 8 electron ở lớp ngoài cùng
CH tr 37 LT
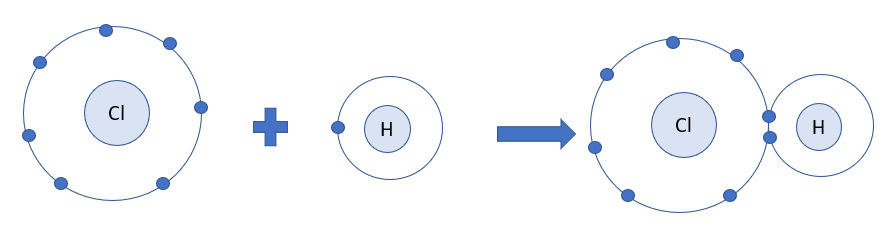
1. Mỗi nguyên tử H kết hợp với 1 nguyên tử Cl tạo thành phân tử hydrogen chloride. Hãy vẽ sơ đồ tạo thành phân tử hydrogen chloride từ nguyên tử H và nguyên tử Cl
2. Mỗi nguyên tử N kết hợp với 3 nguyên tử H tạo thành phân tử ammonia. Hãy vẽ sơ đồ tạo thành liên kết trong phân tử ammonia.
Phương pháp giải:
1. Nguyên tử H và nguyên tử Cl đều là phi kim
+ Nguyên tử H có 1 electron ở lớp ngoài cùng
+ Nguyên tử Cl có 7 electron ở lớp ngoài cùng
2. Nguyên tử H và nguyên tử N đều là phi kim
+ Nguyên tử H có 1 electron ở lớp ngoài cùng
+ Nguyên tử N có 5 electron ở lớp ngoài cùng
Lời giải chi tiết:
1.
Nguyên tử H và nguyên tử Cl đều là phi kim
+ Nguyên tử H có 1 electron ở lớp ngoài cùng
+ Nguyên tử Cl có 7 electron ở lớp ngoài cùng
=> Nguyên tử H và Cl đều cần thêm 1 electron để đạt cấu hình electron bền vững của khí hiếm
=> Khi H và Cl liên kết với nhau, mỗi nguyên tử góp 1 electron để tạo ra đôi electron dùng chung
=> Sơ đồ tạo thành phân tử hydrogen chloride từ nguyên tử H và Cl:
2.
Nguyên tử H và nguyên tử N đều là phi kim
+ Nguyên tử H có 1 electron ở lớp ngoài cùng
+ Nguyên tử N có 5 electron ở lớp ngoài cùng
=> Nguyên tử H cần thêm 1 electron và N cần thêm 3 electron để đạt cấu hình electron bền vững của khí hiếm
=> Khi 3 nguyên tử H và 1 nguyên tử N liên kết với nhau, mỗi nguyên tử H góp 1 electron và nguyên tử N góp ra 3 electron để tạo ra 3 đôi electron dùng chung
=> Sơ đồ tạo thành phân tử hydrogen chloride từ nguyên tử H và N:
CH tr 37 CH
Quan sát hình 5.11, hãy cho biết trong phân tử khí carbonic, nguyên tử C có bao nhiêu electron dùng chung với nguyên tử O
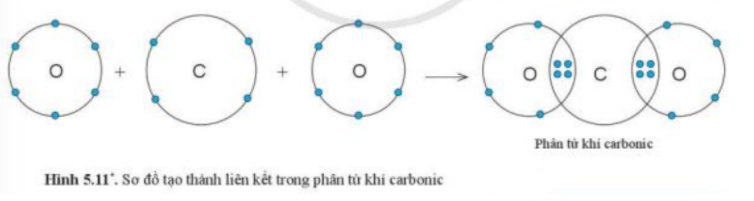
Phương pháp giải:
Trong phân tử khí carbonic có 4 cặp electron dùng chung
Lời giải chi tiết:
Quan sát hình 5.11 có thể thấy được phân tử khí carbonic vó 4 cặp electron dùng chung
=> Nguyên tử C góp 4 electron dùng chung với nguyên tử O
CH tr 37 LT
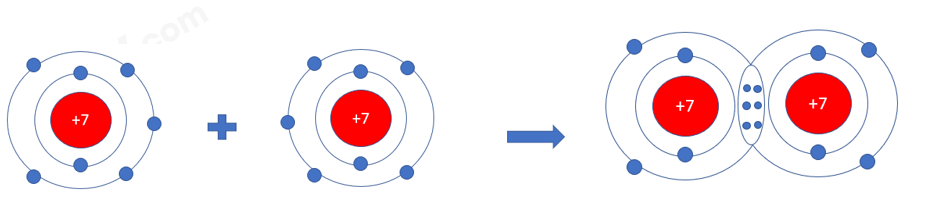
Hai nguyên tử N kết hợp với nhau tạo thành phân tử nitrogen. Hãy vẽ sơ đồ tạo thành liên kết trong phân tử nitrogen
Lời giải chi tiết:
Vì mỗi nguyên tử N đều có 5 electron ở lớp vỏ ngoài cùng => Cần nhận thêm 3 electron vào lớp vỏ ngoài cùng để có lớp vỏ electron bền vững tương tự khí hiếm
=> Khi 2 nguyên tử N liên kết với nhau, mỗi nguyên tử sẽ góp 3 electron ở tạo ra 3 đôi electron dùng chung
CH tr 38 VD
Hãy giải thích các hiện tượng sau:
a) Nước tinh khiết hầu như không dẫn điện, nhưng nước biển lại dẫn được điện.
b) Khi cho đường ăn vào chảo rồi đun nóng sẽ thấy đường ăn nhanh chóng chuyển từ thể rắn sang thể lỏng, làm như vậy với muối ăn thấy muối ăn vẫn ở thể rắn
Phương pháp giải:
- Hợp chất ion có những tính chất chung sau:
+ Là chất rắn ở điều kiện thường
+ Thường có nhiệt độ nóng chảy và nhiệt độ sôi cao
+ Khi tan trong nước tạo ra dung dịch dẫn được điện
- Hợp chất cộng hóa trị có những tính chất chung sau:
+ Nhiệt độ sôi, nhiệt độ nóng chảy thấp
+ Không dẫn điện
Lời giải chi tiết:
a)
- Nước là hợp chất cộng hóa trị giữa nguyên tử O và 2 nguyên tử H => Không dẫn điện
- Nước biển có thành phần chủ yếu là muối ăn (NaCl): đây là hợp chất ion được tạo bởi kim loại điển hình (Na) và phi kim điển hình (Cl) => Dẫn điện
b)
- Đường ăn là hợp chất cộng hóa trị giữa các nguyên tử C, H và O => Nhiệt độ nóng chảy thấp => Khi đun nóng nhanh chóng chuyển từ thể rắn sang thể lỏng
- Muối ăn là hợp chất ion được tạo bởi kim loại điển hình (Na) và phi kim điển hình (Cl) => Nhiệt độ nóng chảy cao => Khi đun nóng trên chảo muối ăn vẫn ở thể rắn
CH tr 38 CH
So sánh một số tính chất chung của chất cộng hóa trị với chất ion
Phương pháp giải:
- Hợp chất ion có những tính chất chung sau:
+ Là chất rắn ở điều kiện thường
+ Thường có nhiệt độ nóng chảy và nhiệt độ sôi cao
+ Khi tan trong nước tạo ra dung dịch dẫn được điện
- Hợp chất cộng hóa trị có những tính chất chung sau:
+ Tồn tại ở cả 3 thể: rắn, lỏng khí ở điều kiện thường
+ Nhiệt độ sôi, nhiệt độ nóng chảy thấp
+ Không dẫn điện
Lời giải chi tiết:
Chất cộng hóa trị
Chất ion
- Ở điều kiện thường tồn tại ở cả 3 thể:
+ Rắn: đường ăn, iodine
+ Lỏng: nước, ethanol
+ Khí: nitrogen, khí carbonic
- Ở điều kiện thường, tồn tại ở thể rắn: sodium chloride, calcium oxide
- Nhiệt độ sôi, nhiệt độ nóng chảy thấp
- Nhiệt độ sôi, nhiệt độ nóng chảy thấp
- Thường có nhiệt độ nóng chảy và nhiệt độ sôi cao: aluminium oxide, calcium oxide…
- Không dẫn điện: đường ăn, ethanol
- Khi tan trong nước tạo ra dung dịch dẫn được điện: sodium chloride, calcium chloride
CH tr 28 MĐ
Chúng ta cảm nhận được mùi thơm của nhiều loại hoa, quả chín là do một số chất có trong hoa, quả chín tách ra những hạt rất nhỏ, lan tỏa vào không khí, tác động lên khứu giác của con người. Những hạt như vậy được gọi là phân tử. Vậy phân tử là gì?

Lời giải chi tiết:
Phân tử là hạt đại diện cho chất, gồm một số nguyên tử gắn kết với nhau bằng liên kết hóa học và thể hiện đầy đủ tính chất hóa học của chất.
Ví dụ: Lấy 1 lượng nhỏ iodine cho vào bình tam giác không màu, đậy kín lại, sau đó đặt vào cốc nước ấm và quan sát. Ta thấy xuất hiện màu tím ở trong bình. Hiện tượng trên là do iodine đã tách ra thành những hạt màu tím vô cùng nhỏ lan tỏa trong bình
CH tr 29 CH
Giải thích một số hiện tượng sau:
a) Khi mở lọ nước hoa hoặc mở lọ đựng một số loại tinh dầu sẽ ngửi thấy có mùi thơm
b) Quần áo sau khi giặt xong, phơi trong không khí một thời gian sẽ khô
Phương pháp giải:
Do các phân tử tách ra, tỏa vào không khí
Lời giải chi tiết:
a) Nước hoa được tạo thành từ những chất có mùi thơm. Khi mở lọ nước hoa hoặc mở lọ đựng một số loại tinh dầu, các phân tử tạo nên mùi thơm tách ra và tỏa vào không khí. Do đó, ta ngửi thấy mùi thơm
b) Khi phơi quần áo trong không khí một thời gian sẽ khô. Đó là do các phân tử nước tách ra và tỏa vào không khí
CH tr 29 CH
Khi nói về nước, có hai ý kiến như sau:
(1) Phân tử nước trong nước đá, nước lỏng và hơi nước là giống nhau
(2) Phân tử nước trong nước đá, nước lỏng và hơi nước là khác nhau
Theo em, ý kiến nào là đúng? Vì sao
Phương pháp giải:
Mỗi phân tử nước gồm hai nguyên tử H và 1 nguyên tử O.
Lời giải chi tiết:
- Theo em ý kiến đúng là: (1) Phân tử nước trong nước đá, nước lỏng và hơi nước là giống nhau
- Vì dù là nước đá, nước lỏng và hơi nước đều cấu tạo từ các phân tử nước (2 nguyên tử H và 1 nguyên tử O). Chúng chỉ khác nhau ở độ bền liên kết giữa các phân tử nước với nhau
CH tr 29 LT
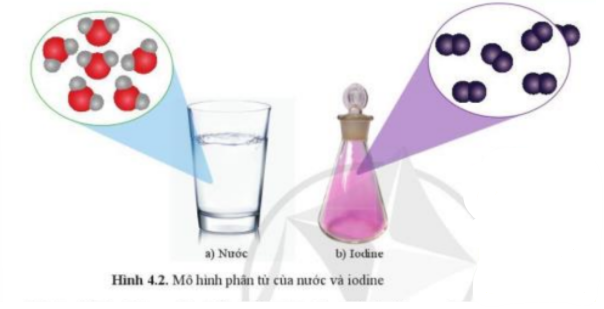
Phát biểu nào sau đây là đúng?
(1) Trong một phân tử, các nguyên tử luôn giống nhau
(2) Trong một phân tử, các nguyên tử luôn khác nhau
(3) Trong một phân tử, các nguyên tử có thể giống nhau hoặc khác nhau
Phương pháp giải:
- Lấy ví dụ từ phân tử nước, phân tử iodine
Lời giải chi tiết:
Phát biểu đúng là phát biểu (3) Trong một phân tử, các nguyên tử có thể giống nhau hoặc khác nhau.
Ví dụ:
- Phân tử nước được cấu tạo từ 2 nguyên tử H và 1 nguyên tử O. Phân tử muối ăn được cấu tạo từ 1 nguyên tử Na và 1 nguyên tử Cl => Các nguyên tử khác nhau
- Phân tử iodine được cấu tạo từ 2 nguyên tử iodine. Phân tử oxygen được cấu tạo từ 2 nguyên tử oxygen => Các nguyên tử giống nhau
CH tr 29 VD
Một số nhiên liệu như xăng, dầu,…dễ tách ra các phân tử và lan tỏa trong không khí. Theo em, cần bảo quản các nhiên liệu trên như thế nào để bảo đảm an toàn?
Phương pháp giải:
Nhiên liệu là những chất dễ cháy
Lời giải chi tiết:
Một số nhiên liệu như xăng, dầu… dễ tách ra các phân tử và lan tỏa trong không khí
=> Cần phải đậy nắp kín để tránh các phân tử tách ra, lan ra ngoài. Hơn nữa, để nhiên liệu xa các nguồn lửa vì nhiên liệu là những chất dễ cháy. Khi ngọn lửa bắt được các phân tử xăng, dầu thì dễ gây cháy nổ
CH tr 30 LT
Dựa vào hình 4.3, tính khối lượng phân tử của fluorine và methane.

Phương pháp giải:
- Khối lượng phân tử bằng tổng khối lượng các nguyên tử có trong phân tử
- Các bước tính khối lượng phân tử
Bước 1: Xác định số nguyên tử của mỗi nguyên tố
Bước 2: Tính khối lượng phân tử
Lời giải chi tiết:
- Xét phân tử Fluorine:
Bước 1: Phân tử Fluorine được cấu tạo từ 2 nguyên tử F (19 amu)
Bước 2: Khối lượng phân tử Fluorine: MFluorine = 19 x 2 = 38 amu
- Xét phân tử Methane:
Bước 1: Phân tử Methane được cấu tạo từ 1 nguyên tử C (12 amu) và 4 nguyên tử H (amu)
Bước 2: Khối lượng phân tử Methane: MMethane = 12x1 + 1x4 = 16 amu
CH tr 30 CH
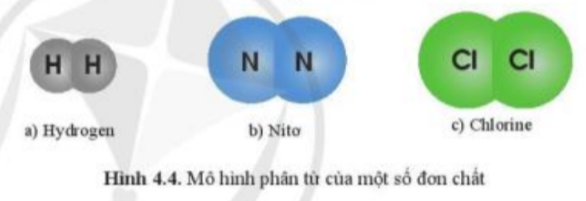
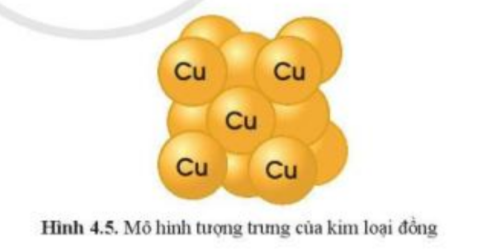
Quan sát hình 4.4 và hình 4.5, cho biết các chất trong hình có đặc điểm gì chung
Phương pháp giải:
Đơn chất là những chất được tạo thành từ 1 nguyên tố hóa học
Lời giải chi tiết:
- Xét hình 4.4:
+ Đơn chất hydrogen được tạo nên từ 1 nguyên tố H
+ Đơn chất nito được tạo nên từ 1 nguyên tố N
+ Đơn chất chlorine được tạo nên từ 1 nguyên tố Cl
- Xét hình 4.5: kim loại đồng được tạo nên từ 1 nguyên tố Cu
=> Hình 4.4 và 4.5 có đặc điểm chung là các đơn chất vì được tạo thành từ 1 nguyên tố hóa học
CH tr 30 LT
Hãy cho biết những chất nào là đơn chất trong các chất sau:
a) Kim loại natri được tạo thành từ nguyên tố Na.
b) Lactic acid có trong sữa chua được tạo thành từ các nguyên tố C, H và O
c) Kim cương được tạo thành từ nguyên tố C
d) Muối ăn được tạo thành từ các nguyên tố Na và Cl
Phương pháp giải:
Đơn chất là những chất được tạo thành từ 1 nguyên tố hóa học
Lời giải chi tiết:
a) Được tạo thành từ 1 nguyên tố Na => Đơn chất
b) Được tạo thành từ 3 nguyên tố C, H và O => Không phải đơn chất
c) Được tạo thành từ 1 nguyên tố C => Đơn chất
d) Được tạo thành từ 2 nguyên tố Na và Cl => Không phải đơn chất
CH tr 31 VD
1. Nêu hai đơn chất kim loại thường được sử dụng để làm dây dẫn điện
2. Đơn chất nào được tạo ra trong quá trình quang hợp của cây xanh và có vai trò quan trọng đối với sự sống của con người?
Phương pháp giải:
1. Các kim loại thường được sử dụng để làm dây dẫn điện: đồng, bạc, nhôm…
2. Trong quá trình quang hợp, cây xanh lấy đi khí carbon dioxide và nhả ra khí oxygen
Lời giải chi tiết:
1. 2 đơn chất kim loại thường được sử dụng để làm dây dẫn điện là: Copper (đồng), Aluminium (Nhôm)
2. Trong quá trình quang hợp, khí oxygen được tạo ra (có vai trò quan trọng, duy trì sự sống của con người)
=> Đơn chất oxygen
CH tr 31 CH
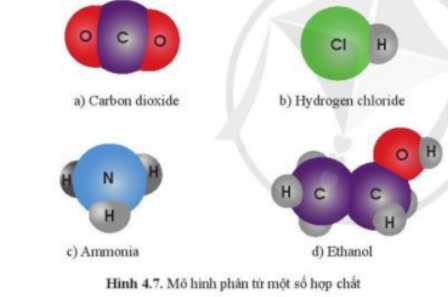
Quan sát hình 4.7 và nêu đặc điểm chung của các chất có trong hình.
Phương pháp giải:
Hợp chất là những chất do hai hoặc nhiều nguyên tố hóa học tạo thành
Lời giải chi tiết:
- Hình 4.7a được tạo thành từ 2 nguyên tố C và H
- Hình 4.7b được tạo thành từ 2 nguyên tố Cl và H
- Hình 4.7c được tạo thành từ 2 nguyên tố N và H
- Hình 4.7d được tạo thành từ 3 nguyên tố C, H và O
=> Các chất trong hình 4.7 là những chất do hai hoặc nhiều nguyên tố hóa học tạo thành
CH tr 31 LT
Trong các chất sau, chất nào là đơn chất, chất nào là hợp chất?
a) Đường ăn
b) Nước
c) Khí hydrogen (được tạo thàn từ nguyên tố H)
d) Vitamin C (được tạo thành từ các nguyên tố C, H và O)
e) Lưu huỳnh (được tạo thành từ nguyên tố S)
Phương pháp giải:
- Đơn chất là những chất được tạo thành từ một nguyên tố hóa học
- Hợp chất là những chất do hai hoặc nhiều nguyên tố hóa học tạo thành
Lời giải chi tiết:
a) Đường ăn được tạo thành từ 3 nguyên tố C, H và O => Hợp chất
b) Nước được tạo thành từ 2 nguyên tố H và O => Hợp chất
c) Khí hydrogen được tạo thành từ 1 nguyên tố H => Đơn chất
d) Vitamin C được tạo thành từ 3 nguyên tố C, H và O => Hợp chất
e) Lưu huỳnh được tạo thành từ 1 nguyên tố S => Đơn chất
CH tr 32 LT
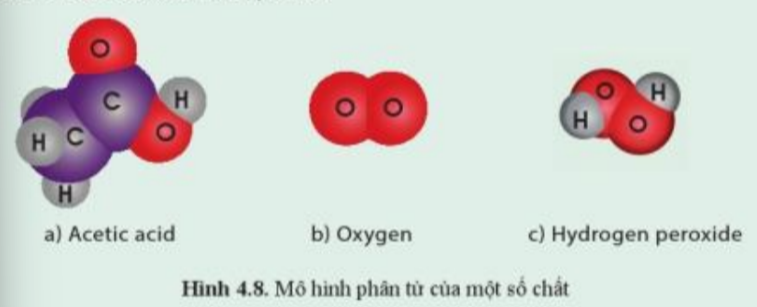
Acetic acid có trong giấm ăn và là chất được sử dụng nhiều trong công nghiệp; oxygen chiếm khoảng 21% thể tích không khí, có vai trò quan trọng đối với sự sống; hydrogen peroxide có nhiều ứng dụng trong công nghiệp và là chất sát khuẩn mạnh. Quan sát hình 4.8, cho biết chất nào là đơn chất, chất nào là hợp chất?
Phương pháp giải:
- Đơn chất là những chất được tạo thành từ một nguyên tố hóa học
- Hợp chất là những chất do hai hoặc nhiều nguyên tố hóa học tạo thành
Lời giải chi tiết:
- Quan sát hình 4.8 thấy:
+ Acetic acid được tạo thành từ 3 nguyên tố C, H và O => Hợp chất
+ Oxygen được tạo thành từ 1 nguyên tố O => Đơn chất
+ Hydrogen peroxide được tạo thành từ 2 nguyên tố O và H => Hợp chất