[SGK Khoa học tự nhiên Lớp 8 Cánh diều] Chủ đề 2. Acid - Base - pH - Oxide - Muối
Hướng dẫn học bài: Chủ đề 2. Acid - Base - pH - Oxide - Muối - Môn Khoa học tự nhiên Lớp 8 Lớp 8. Đây là sách giáo khoa nằm trong bộ sách 'SGK Khoa học tự nhiên Lớp 8 Cánh diều Lớp 8' được biên soạn theo chương trình đổi mới của Bộ giáo dục. Hi vọng, với cách hướng dẫn cụ thể và giải chi tiết các bé sẽ nắm bài học tốt hơn.
CH tr 47 MĐ
Các loại rau quả trong hình dưới đây có đặc điểm gì giống nhau? Theo em vì sao chúng lại có đặc điểm giống nhau đó
Phương pháp giải:
Dựa vào hiểu biết của em về các loại quả ngoài đời sống và quan sát hình 8.1 để trả lời câu hỏi
Lời giải chi tiết:
Các quả ở trên hình đều có vị chua vì nó có chứa một lượng acid trong thành phần
CH tr 47 CH1
Nêu đặc điểm chung về thành phần phân tử của các acid.
Phương pháp giải:
Dựa vào khái niện về acid SGK tr 47 để trả lời câu hỏi
Lời giải chi tiết:
Thành phần phân tử của các acid đều có chứa nguyên tử hydrogen
CH tr 47 LT1
Viết sơ đồ tạo thành ion H+ từ nitric acid (HNO3)
Phương pháp giải:
Acid tạo ra ion H+ theo sơ đồ sau:
Acid → ion H+ + ion âm gốc acid
Lời giải chi tiết:
Sơ đồ tạo thành ion H+ từ nitric acid:
HNO3 → H+ + NO3−.
CH tr 48 LT2
Khi thảo luận về tác dụng của dung dịch acid với quỳ tím có hai ý kiến sau:
a) Nước làm quỳ tím đổi màu.
b) Dung dịch acid làm quỳ tím đổi màu.
Để xuất một thí nghiệm để xác định ý kiến đúng trong hai ý kiến trên.
Phương pháp giải:
Đề xuất thí nghiệm:
Chuẩn bị:
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt, giá đỡ thí nghiệm.
- Hoá chất: Các dung dịch acid: HCl, HNO3, H2SO4; giấy quỳ tím; nước cất.
Tiến hành:
- Lấy 4 ống nghiệm, đánh số từ 1 đến 4.
- Cho vào ống nghiệm 1 khoảng 2 mL dung dịch HCl, ống nghiệm 2 khoảng 2 mL dung dịch HNO3, ống nghiệm 3 khoảng 2 mL dung dịch H2SO4, ống nghiệm 4 khoảng 2 mL nước cất.
- Sau đó cho lần lượt vào mỗi ống nghiệm 1 mẩu quỳ tím. Quan sát sự đổi màu của quỳ tím và rút ra nhận xét.
Lời giải chi tiết:
Đề xuất thí nghiệm:
Chuẩn bị:
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt, giá đỡ thí nghiệm.
- Hoá chất: Các dung dịch acid: HCl, HNO3, H2SO4; giấy quỳ tím; nước cất.
Tiến hành:
- Lấy 4 ống nghiệm, đánh số từ 1 đến 4.
- Cho vào ống nghiệm 1 khoảng 2 mL dung dịch HCl, ống nghiệm 2 khoảng 2 mL dung dịch HNO3, ống nghiệm 3 khoảng 2 mL dung dịch H2SO4, ống nghiệm 4 khoảng 2 mL nước cất.
- Sau đó cho lần lượt vào mỗi ống nghiệm 1 mẩu quỳ tím. Quan sát sự đổi màu của quỳ tím và rút ra nhận xét.
CH tr 48 LT3
Lần lượt nhỏ lên ba mẩu giấy quỳ tím mỗi dung dịch sau:
a) Nước đường.
b) Nước chanh.
c) Nước muối (dung dịch NaCl).
Trường hợp nào quỳ tím sẽ chuyển sang màu đỏ?
Phương pháp giải:
Dung dịch acid làm quỳ tím chuyển sang màu đỏ.
Lời giải chi tiết:
Trường hợp b) nước chanh sẽ làm quỳ tím chuyển sang màu đỏ do nước chanh chứa nhiều acid citric.
CH tr 49 VD1
Người ta thường tránh muối dưa, cà trong các dụng cụ làm bằng nhôm. Cho biết lí do của việc làm trên.
Phương pháp giải:
Dung dịch acid tác dụng được với nhiều kim loại
Lời giải chi tiết:
Các loại dưa, cà muối chua có chứa nhiều acid. Tránh muối dưa, cà trong các dụng cụ bằng nhôm do acid có thể tác dụng với kim loại nhôm giải phóng ion kim loại gây độc hại cho cơ thể.
CH tr 49 LT4
Viết phương trình hoá học xảy ra trong các trường hợp sau:
a) Dung dịch H2SO4 loãng tác dụng với Zn.
b) Dung dịch HCl loãng tác dụng với Mg.
Phương pháp giải:
Acid + Kim loại → muối + H2
Lời giải chi tiết:
a) Zn + H2SO4 (loãng) → ZnSO4 + H2↑.
b) Mg + 2HCl → MgCl2 + H2↑.
CH tr 49 CH2
Dựa vào hình 8.2, nêu một số ứng dụng của hydrochloric acid.
Phương pháp giải:
Quan sát hình 8.2 để nêu ra các ứng dụng của hydrochloric acid
Lời giải chi tiết:
Một số ứng dụng của hydrochloric acid:
- Tẩy rửa kim loại;
- Sản xuất chất dẻo;
- Điều chế glucose;
- Sản xuất dược phẩm ….
CH tr 50 CH3
Dựa vào hình 8.3, nêu một số ứng dụng của sulfuric acid.
Phương pháp giải:
Quan sát hình 8.3 và nêu ra ứng dụng của sulfuric acid
Lời giải chi tiết:
Một số ứng dụng của sulfuric acid:
- Sản xuất giấy, tơ sợi;
- Sản xuất ắc quy;
- Sản xuất sơn;
- Sản xuất chất dẻo;
- Sản xuất phân bón…
CH tr 50 CH4
Dựa vào hình 8.4, nêu một số ứng dụng của acetic acid.
Lời giải chi tiết:
Một số ứng dụng của acetic acid:
- Sản xuất tơ nhân tạo;
- Sản xuất chất dẻo;
- Sản xuất dược phẩm;
- Sản xuất phẩm nhuộm;
- Sản xuất thuốc diệt côn trùng …
CH tr 50 VD2
Nêu tên một số món ăn có sử dụng giấm ăn trong quá trình chế biến.
Phương pháp giải:
Dựa vào kiến thức của em ngoài đời sống để trả lời câu hỏi
Lời giải chi tiết:
Một số món ăn sử dụng giấm trong quá trình chế biến: nộm; bò nhúng giấm; canh chua; …
CH tr 72 BT1
Trong các chất sau, chất nào là acid, base, kiềm?
HCl, CuO, KOH, CaCO3, H2SO4, Fe(OH)2.
Phương pháp giải:
Dựa vào khái niệm của acid, base và muối
Lời giải chi tiết:
- Chất là acid: HCl, H2SO4.
- Chất là base: KOH, Fe(OH)2.
- Chất là kiềm: KOH.
CH tr 72 BT2
Trong các chất sau, chất nào là muối, oxide base, oxide acid: CuSO4, SO2, MgCl2, CaO, Na2CO3. Viết tên gọi các muối.
Phương pháp giải:
Dựa vào khái niệm acid, oxide và muối để phân loại các chất
Lời giải chi tiết:
- Chất là muối: CuSO4; MgCl2; Na2CO3.
Tên gọi các muối:
CuSO4: copper (II) sulfate.
MgCl2: magnesium chloride.
Na2CO3: sodium carbonate.
- Chất là oxide base: CaO.
- Chất là oxide acid: SO2.
CH tr 72 BT3
Chất nào trong dãy chất sau: CuO, Mg(OH)2, Fe, SO2, HCl, CuSO4 tác dụng được với:
a) Dung dịch NaOH.
b) Dung dịch H2SO4 loãng.
Viết phương trình hoá học của các phản ứng (nếu có).
Phương pháp giải:
Dựa vào tính chất hóa học của base và acid để trả lời câu hỏi và viết phương trình
Lời giải chi tiết:
a) Các chất tác dụng được với dung dịch NaOH là: SO2, HCl, CuSO4.
Phương trình hoá học minh hoạ:
SO2 + 2NaOH → Na2SO3 + H2O
HCl + NaOH → NaCl + H2O
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
b) Các chất tác dụng được với dung dịch H2SO4 loãng là: CuO, Mg(OH)2, Fe.
Phương trình hoá học minh hoạ:
CuO + H2SO4 → CuSO4 + H2O
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
Fe + H2SO4 (loãng) → FeSO4 + H2↑.
CH tr 72 BT4
Viết các phương trình hoá học theo các sơ đồ sau:
a) HCl + ? → NaCl + H2O
b) NaOH + ? → Cu(OH)2↓ + ?
c) KOH + ? → K2SO4 + ?
d) Ba(NO3)2 + ? → BaSO4↓ + ?
Phương pháp giải:
Dựa vào tính chất hóa học của muối, acid, base
Lời giải chi tiết:
a) HCl + NaOH → NaCl + H2O
b) 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl
c) 2KOH + CuSO4 → K2SO4 + Cu(OH)2↓
d) Ba(NO3)2 + Na2SO4 → BaSO4↓ + 2NaNO3.
CH tr 72 BT5

Phương pháp giải:
Dựa vào tính chất hóa học của acid, base và muối để hoàn thành sơ đồ hóa học.
Lời giải chi tiết:
a)
CuO + H2SO4 → CuSO4 + H2O
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
b)
Mg + 2HCl → MgCl2 + H2↑
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl.
c)
2NaOH + H2SO4 → Na2SO4 + 2H2O
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓.
d)
K2CO3 + CaCl2 → CaCO3↓ + 2KCl
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O.
CH tr 72 BT6
Cho 100 mL dung dịch Na2SO4 0,5 M tác dụng vừa đủ với dung dịch BaCl2 thì thu được m gam kết tủa.
a) Viết phương trình hoá học của phản ứng xảy ra.
b) Tính m.
c) Tính nồng độ mol của dung dịch BaCl2, biết thể tích dung dịch BaCl2 đã dùng là 50 mL.
Phương pháp giải:
Dựa vào tính chất hóa học của muối
Lời giải chi tiết:
a) Phương trình hoá học của phản ứng xảy ra:
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
b) Đổi 100 ml = 0,1 lít.
Theo bài ra: n Na2SO4 = 0,1 × 0,5 = 0,05 (mol)
Theo phương trình hoá học: n BaSO4 = nNa2SO4 = 0,05(mol).
Vậy m = 0,05 × (137 + 32 + 16 × 4) = 11,65 (gam).
Theo phương trình hoá học: nBaCl2 = nNa2SO4 = 0,05(mol).
Đổi 50 mL = 0,05 lít.
Nồng độ mol của dung dịch BaCl2 là: CM = n : V = 0,05 : 0,05
CH tr 72 BT7
Viết các phương trình hoá học điều chế MgCl2 trực tiếp từ NgO, Mg(OH)2, MgSO4.
Phương pháp giải:
Dựa vào tính chất của acid, base, muối.
Lời giải chi tiết:
Các phương trình hoá học:
MgO + 2HCl → MgCl2 + H2O
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
MgSO4 + BaCl2 → MgCl2 + BaSO4↓.
CH tr 72 BT8
Biết dung dịch NaCl có pH bằng 7. Chỉ dùng quỳ tím, nêu cách nhận biết các dung dịch không màu, đựng trong ba ống nghiệm riêng rẽ: NaOH, HCl và NaCl.
Phương pháp giải:
Dựa vào tính chất của acid, base, muối.
Lời giải chi tiết:
Cho vào mỗi ống nghiệm một mẩu quỳ tím:
- Quỳ tím chuyển sang màu xanh → dung dịch NaOH.
- Quỳ tím chuyển sang màu đỏ → dung dịch HCl.
- Quỳ tím không chuyển màu → dung dịch NaCl.
CH tr 72 BT9
Việc bón phân NPK cho cây cà phê sau khi trồng bốn năm thời kì như sau: 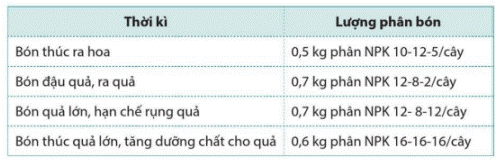 được chia thành bốn
được chia thành bốn
a) Tính lượng N đã cung cấp cho cây trong cả bốn thời kì.
b) Nguyên tố dinh dưỡng potassium được bổ sung cho cây nhiều nhất ở thời kì nào?
Phương pháp giải:
Dựa vào công thức tính % khối lượng nguyên tố.
Lời giải chi tiết:
Chú ý: Các số sau chữ NPK, ví dụ NPK 10 – 12 – 5 cho biết hàm lượng dinh dưỡng có trong phân.
a) Lượng N cung cấp cho cây trong thời kì bón thúc ra hoa là:
0,5 × 10 : 100 = 0,05(kg).
Lượng N cung cấp cho cây trong thời kì bón đậu quả, ra quả là:
0,7 × 12 : 100 = 0,084(kg).
Lượng N cung cấp cho cây trong thời kì bón quả lớn, hạn chế rụng quả là:
0,7 × 12 : 100 = 0,084(kg).
Lượng N cung cấp cho cây trong thời kì bón thúc quả lớn, tăng dưỡng chất cho quả là:
0,6 × 16 : 100 = 0,096(kg).
Lượng N đã cung cấp cho cây trong cả bốn thời kì là:
0,05 + 0,084 + 0,084 + 0,096 = 0,314 (kg).
b) Nguyên tố dinh dưỡng potassium được bổ sung cho cây nhiều nhất ở thời kì bón thúc quả lớn, tăng dưỡng chất cho quả.
CH tr 68 MĐ
Câu tục ngữ: “Nhất nước, nhì phân, tam cần, tứ giống” cho thấy phân bón có vai trò như thế nào trong sản xuất nông nghiệp?
Phương pháp giải:
Dựa vào kiến thức về các loại muối
Lời giải chi tiết:
Câu tục ngữ: “Nhất nước, nhì phân, tam cần, tứ giống” thể hiện kinh nghiệm trồng lúa nước nói riêng và sản xuất nông nghiệp nói chung. Trong đó nước là yếu tố quan trọng nhất được đặt lên hàng đầu, tiếp theo là phân bón. Điều đó cho thấy phân bón có vai trò quan trọng trong sản xuất nông nghiệp.
CH tr 68 CH1
Phân bón hoá học là gì? Theo nhu cầu của cây trồng, phân bón được chia thành những loại nào?
Phương pháp giải:
Dựa vào khái niệm của phân bón hóa học
Lời giải chi tiết:
- Phân bón hoá học là những hoá chất có chứa các nguyên tố dinh dưỡng dùng để bón cho cây nhằm nâng cao năng suất của cây trồng.
- Phân bón hoá học được chia thành ba loại:
+ Phân bón đa lượng: cung cấp cho cây các nguyên tố dinh dưỡng: N, P, K.
+ Phân bón trung lượng: cung cấp cho cây các nguyên tố dinh dưỡng: Ca, Mg, S.
+ Phân bón vi lượng: cung cấp một lượng rất nhỏ các nguyên tố dinh dưỡng: Si, B, Zn, Fe, Cu,…
CH tr 69 CH2
Các loại phân đạm đều chứa nguyên tố hoá học nào? Nêu tác dụng chính của phân đạm đối với cây trồng.
Phương pháp giải:
Dựa vào phân loại phân bón hóa học
Lời giải chi tiết:
- Phân đạm là những hợp chất cung cấp nguyên tố dinh dưỡng nitrogen (N) cho cây trồng.
- Phân đạm kích thích quá trình sinh trưởng giúp cây trồng phát triển nhanh, cho nhiều hạt, củ hoặc quả và làm tăng tỉ lệ protein thực vật.
CH tr 69 CH3
Phân lân cung cấp nguyên tố dinh dưỡng nào cho cây trồng? Nêu tác dụng chính của phân lân đối với cây trồng.
Phương pháp giải:
Dựa vào thành phần nguyên tố trong phân bón hóa học
Lời giải chi tiết:
- Phân lân là những hợp chất cung cấp cho cây trồng nguyên tố dinh dưỡng phosphorus (P) dưới dạng các muối phosphate.
- Phân lân kích thích sự phát triển của rễ cây, quá trình đẻ nhánh và nảy chồi; thúc đẩy cây ra hoa, quả sớm; tăng khả năng chống chịu của cây.
CH tr 70 CH4
Phân bón hoá học có ảnh hưởng như thế nào đến môi trường?
Phương pháp giải:
Dựa vào ứng dụng của phân bón hóa học
Lời giải chi tiết:
Nếu sử dụng không hợp lí, phân bón hoá học có thể gây nên một số ảnh hưởng tiêu cực đến môi trường.
Phân bón hoá học dư thừa có thể theo nguồn nước ngấm sâu vào đất dẫn đến ô nhiễm đất, ô nhiễm nguồn nước ngầm. Phân bón bị rửa trôi cũng làm ô nhiễm nguồn nước mặt.
CH tr 71 CH5
Khi sử dụng phân bón hoá học cần tuân thủ những nguyên tắc nào?
Phương pháp giải:
Dựa vào nguyên tắc bón phân
Lời giải chi tiết:
Để giảm thiểu ô nhiễm môi trường, trong quá trình sử dụng cần tuân thủ các nguyên tắc sau:
- Bón đúng loại phân: cần căn cứ vào nhu cầu dinh dưỡng của cây trồng trong từng giai đoạn sinh trưởng, từng loại đất để lựa chọn loại phân phù hợp.
- Bón đúng lúc: cần chia ra nhiều lần bón và đúng thời điểm cây đang có nhu cầu được cung cấp chất dinh dưỡng.
- Bón đúng liều lượng: không bón thiếu, không bón thừa; thường xuyên theo dõi quá trình phát triển của cây trồng, đất đai, biến đổi thời tiết để có thể điều chỉnh lượng phân bón cho phù hợp.
- Bón đúng cách: cần lựa chọn đúng cách bón cho từng loại cây trồng, từng vụ sản xuất, từng loại phân và từng loại đất, để hạn chế phân bị rửa trôi, phân huỷ hoặc làm cây bị tổn thương …
CH tr 71 CH
Lúa là cây lương thực chủ yếu ở nước ta, em hãy tìm hiểu và cho biết: Quá trình sinh trưởng của cây lúa được chia thành mấy giai đoạn, mỗi giai đoạn đó cần bón cho lúa loại phân nào.
Phương pháp giải:
Dựa vào ứng dụng của phân bón
Lời giải chi tiết:
- Quá trình sinh trưởng của cây lúa có thể được chia thành 4 giai đoạn: giai đoạn mạ; giai đoạn đẻ nhánh; giai đoạn làm đòng; giai đoạn tạo hạt.
- Kĩ thuật bón phân cho lúa trong từng giai đoạn:
+ Giai đoạn mạ, thực hiện bón lót.
Trước khi bón lót, nên bón thêm phân chuồng khi bừa đất lần cuối. Điều này giúp đất phì nhiêu màu mỡ, rất tốt cho cây trồng.
Trong giai đoạn sinh trưởng đầu, cây lúa sẽ hấp thụ khá nhiều phân lân. Vì thế, phân lân cần phải bón lót toàn bộ hoặc bón lót và bón thúc sớm. Ngoài ra chúng ta nên bón kèm theo phân đạm và phân kali.
+ Giai đoạn đẻ nhánh, thực hiện bón thúc cây đẻ nhánh.
Đây là giai đoạn bón khi lúa được 2 – 3 lá (sau khi cấy khoảng 15 đến 20 ngày) giúp mạ phát triển nhanh, đẻ nhánh sớm.Trong giai đoạn này chúng ta nên kết hợp phân đạm với phân lân. Đây là thời điểm nhu cầu cần phân đạm của cây tăng lên đáng kể. Bón đạm sẽ giúp cây đẻ nhánh nhanh hơn. Đối với đất phèn hoặc đất quá chua, việc bón thúc lân cho lúa là rất cần thiết.
+ Giai đoạn làm đòng, bón thúc cây lúa trổ đòng
Giai đoạn này bón thúc sau khi gieo cấy từ 40 – 45 ngày. Đây chính là khâu quan trọng quyết định đến năng suất cây trồng.
Nên sử dụng phân bón kali để thúc đòng nếu như chúng ta gieo cấy với giống lúa đẻ nhánh ít, giống dài ngày, hoặc giống gieo cấy thưa, gieo cấy ở đất phèn, đất kiềm hoặc mưa nhiều.
+ Giai đoạn tạo hạt
Đây là giai đoạn bón đón đòng, trước khi trổ bông khoảng 15-20 ngày. Sau khi lúa trổ có thể nuôi hạt bằng cách phun phân bón lá 1 – 2 lần nhằm tăng lượng hạt chắc, tăng năng suất lúa.
CH tr 62 MĐ
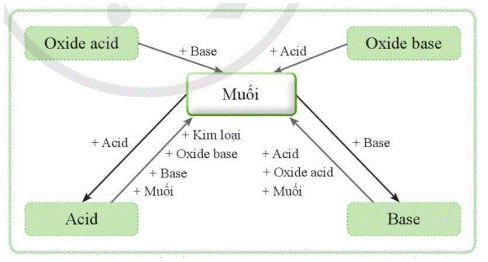
Muối là loại hợp chất có nhiều trong tự nhiên, trong nước biển, trong đất, trong các mỏ (hình 12.1). Vậy muối là gì? Muối có những tính chất hoá học nào? Mối liên hệ giữa muối với các loại hợp chất khác được thể hiện như thế nào?
Lời giải chi tiết:
- Muối là những hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium (NH4+).
- Tính chất hoá học của muối:
+ Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
+ Muối có thể tác dụng với dung dịch acid tạo thành muối mới và acid mới.
+ Muối có thể tác dụng với dung dịch base tạo thành muối mới và base mới.
+ Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
- Mối liên hệ giữa muối và các hợp chất khác được thể hiện bằng sơ đồ sau:
CH tr 63 CH
Cho biết các muối: Na3PO4, MgCl2, CaCO3, CuSO4, KNO3 tương ứng với acid nào trong số các acid sau: HCl, H2SO4, H3PO4, HNO3, H2CO3.
Lời giải chi tiết:
Muối
Na3PO4
MgCl2
CaCO3
CuSO4
KNO3
Acid tương ứng
H3PO4
HCl
H2CO3
H2SO4
HNO3
CH tr 63 LT1
Gọi tên các muối sau: KCl, ZnSO4, MgCO3, Ca3(PO4)2, Cu(NO3)2, Al2(SO4)3.
Phương pháp giải:
Tên muối = tên cation + tên anion
Công thức hoá học
Tên gọi
KCl
Potassium chloride
ZnSO4
Zinc sulfate
MgCO3
Magnesium carbonate
Ca3(PO4)2
Calcium phosphate
Cu(NO3)2
Copper(II) nitrate
Al2(SO4)3
Aluminium sulfate
Lời giải chi tiết:
Công thức hoá học
Tên gọi
KCl
Potassium chloride
ZnSO4
Zinc sulfate
MgCO3
Magnesium carbonate
Ca3(PO4)2
Calcium phosphate
Cu(NO3)2
Copper(II) nitrate
Al2(SO4)3
Aluminium sulfate
CH tr 63 LT2
Sử dụng bảng tính tan, cho biết muối nào sau đây tan được trong nước: K2SO4, Na2CO3, AgNO3, KCl, CaCl2, BaCO3, MgSO4
Phương pháp giải:
Sử dụng bảng tính tan của muối.
Lời giải chi tiết:
Các muối tan trong nước là: K2SO4, Na2CO3, AgNO3, KCl, CaCl2, MgSO4.
CH tr 64 LT3
Dung dịch CuSO4 có màu xanh lam, dung dịch ZnSO4 không màu. Viết phương trình hoá học xảy ra khi ngâm Zn trong dung dịch CuSO4, dự đoán sự thay đổi về màu của dung dịch trong quá trình trên.
Phương pháp giải:
Dựa vào tính chất hóa học của muối: Kim loại tác dụng với muối.
- Phương trình hoá học xảy ra: Zn + CuSO4 → ZnSO4 + Cu.
- Dự đoán sự thay đổi màu của dung dịch: Dung dịch nhạt màu dần đến mất màu.
Lời giải chi tiết:
- Phương trình hoá học xảy ra: Zn + CuSO4 → ZnSO4 + Cu.
- Dự đoán sự thay đổi màu của dung dịch: Dung dịch nhạt màu dần đến mất màu.
CH tr 64 LT4
Viết phương trình hoá học của phản ứng xảy ra trong các trường hợp sau:
a) Cho Fe vào dung dịch CuSO4.
b) Cho Zn vào dung dịch AgNO3.
Phương pháp giải:
Dựa vào tính chất hóa học của muối: Kim loại tác dụng với muối.
Lời giải chi tiết:
Phương trình hoá học xảy ra:
a) Fe + CuSO4 → FeSO4 + Cu.
b) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag.
CH tr 64 TH1
Chuẩn bị
● Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt, miếng bìa màu trắng.
● Hoá chất: Mẩu dây đồng, dung dịch AgNO3.
Tiến hành
● Cho mẩu dây đồng (dài khoảng 2 cm) vào ống nghiệm, thêm vào ống nghiệm khoảng 2 ml dung dịch AgNO3. Đặt miếng bìa trắng sau ống nghiệm.
● Mô tả các hiện tượng xảy ra.
● Bề mặt sợi dây đồng và màu dung dịch trong ống nghiệm thay đổi như thế nào? Giải thích.
Phương pháp giải:
Quan sát thí nghiệm để trả lời câu hỏi.
Lời giải chi tiết:
- Hiện tượng: Mẩu dây đồng tan dần, có lớp kim loại trắng bạc bám ngoài dây đồng, dung dịch sau phản ứng có màu xanh.
- Bề mặt sợi dây đồng có lớp kim loại trắng bạc, dung dịch trong ống nghiệm đậm màu dần. Do dung dịch AgNO3 đã phản ứng với kim loại Cu theo phương trình hoá học sau:
2AgNO3 + Cu → Cu(NO3)2 + 2Ag↓.
Dung dịch Cu(NO3)2 có màu xanh.
CH tr 64 TH2
Chuẩn bị
● Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt.
● Hoá chất: Dung dịch BaCl2, dung dịch H2SO4 loãng.
Tiến hành
● Lấy khoảng 2 ml dung dịch BaCl2 cho vào ống nghiệm, sau đó nhỏ từ từ từng giọt H2SO4 vào ống nghiệm (khoảng 5 giọt).
● Mô tả các hiện tượng xảy ra. Giải thích.
Phương pháp giải:
Quan sát thí nghiệm để trả lời câu hỏi.
Lời giải chi tiết:
- Hiện tượng: Xuất hiện kết tủa trắng.
- Giải thích: Dung dịch BaCl2 phản ứng với dung dịch H2SO4 tạo thành kết tủa trắng là BaSO4. Phương trình hoá học:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl.
CH tr 65 LT5
Dự đoán các hiện tượng xảy ra trong các thí nghiệm sau:
a) Nhỏ dung dịch H2SO4 loãng vào dung dịch Na2CO3.
b) Nhỏ dung dịch HCl loãng vào dung dịch AgNO3.
Giải thích và viết phương trình hoá học xảy ra (nếu có).
Phương pháp giải:
Dựa vào tính chất hóa học của muối: Muối tác dụng với acid.
Lời giải chi tiết:
a) Hiện tượng: có khí thoát ra.
Giải thích: H2SO4 loãng tác dụng với Na2CO3 sinh ra khí CO2 theo phương trình hoá học: H2SO4 + Na2CO3 → Na2SO4 + CO2↑ + H2O.
b) Hiện tượng: xuất hiện kết tủa trắng.
Giải thích: HCl tác dụng với AgNO3 sinh ra kết tủa trắng là AgCl theo phương trình hoá học: HCl + AgNO3 → AgCl↓ + HNO3.
CH tr 65 TH3
Chuẩn bị
● Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt.
● Hoá chất: Dung dịch CuSO4, dung dịch NaOH.
Tiến hành
● Lấy khoảng 2 mL dung dịch CuSO4 cho vào ống nghiệm, sau đó nhỏ từ từ từng giọt dung dịch NaOH vào ống nghiệm.
● Mô tả các hiện tượng xảy ra. Giải thích.
Phương pháp giải:
Dựa vào tính chất hóa học của muối: Muối tác dụng với base.
Lời giải chi tiết:
- Hiện tượng: Xuất hiện kết tủa xanh, dung dịch nhạt màu dần.
- Giải thích: CuSO4 tác dụng với NaOH sinh ra kết tủa Cu(OH)2 có màu xanh. Phương trình hoá học: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
CH tr 65 LT6
Viết phương trình hoá học xảy ra trong các trường hợp sau:
a) Dung dịch FeCl3 tác dụng với dung dịch NaOH.
b) Dung dịch CuCl2 tác dụng với dung dịch KOH.
Phương pháp giải:
Dựa vào tính chất hóa học của muối: Muối tác dụng với base.
Lời giải chi tiết:
a) FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
b) CuCl2 + 2KOH → Cu(OH)2↓ + 2KCl
CH tr 66 TH4
Chuẩn bị
● Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt.
● Hoá chất: Dung dịch Na2CO3, dung dịch CaCl2.
Tiến hành
Lấy khoảng 2 mL dung dịch Na2CO3 cho vào ống nghiệm, sau đó nhỏ từ từ từng giọt CaCl2 vào ống nghiệm.
Báo cáo kết quả, thảo luận
Mô tả các hiện tượng xảy ra. Giải thích.
Phương pháp giải:
Quan sát thí nghiệm để trả lời câu hỏi.
Lời giải chi tiết:
- Hiện tượng: Xuất hiện kết tủa trắng.
- Giải thích: Dung dịch Na2CO3 tác dụng với dung dịch CaCl2 sinh ra kết tủa trắng là CaCO3 theo phương trình hoá học:
Na2CO3 + CaCl2 → CaCO3↓ + 2NaCl.
CH tr 66 LT8
Viết phương trình hoá học xảy ra giữa các dung dịch sau:
a) Dung dịch NaCl với dung dịch AgNO3.
b) Dung dịch Na2SO4 với dung dịch BaCl2.
c) Dung dịch K2CO3 với dung dịch Ca(NO3)2.
Phương pháp giải:
Sử dụng tính chất hóa học của muối: Muối tác dụng với muối.
Lời giải chi tiết:
a) NaCl + AgNO3 → AgCl↓ + NaNO3.
b) Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl.
c) K2CO3 + Ca(NO3)2 → CaCO3↓ + 2KNO3.
CH tr 66 LT9
Viết các phương trình hoá học theo sơ đồ chuyển hoá sau:
CuO → CuSO4 → CuCl2 → Cu(OH)2
Phương pháp giải:
Sửa dụng tính chát hóa học của muối và oxide base.
Các phương trình hoá học theo sơ đồ:
(1) CuO + H2SO4 → CuSO4 + H2O.
(2) CuSO4 + BaCl2 → BaSO4↓ + CuCl2.
(3) CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl.
Lời giải chi tiết:
Các phương trình hoá học theo sơ đồ:
(1) CuO + H2SO4 → CuSO4 + H2O.
(2) CuSO4 + BaCl2 → BaSO4↓ + CuCl2.
(3) CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl.
CH tr 67 VD
Muối Al2(SO4)3 được dùng trong công nghiệp để nhuộm vải, thuộc da, làm trong nước, … Tính khối lượng Al2(SO4)3 tạo thành khi cho 51 kg Al2O3 tác dụng hết với dung dịch H2SO4.
Phương pháp giải:
Đổi 51 kg = 51000 gam.
nAl2O3 = 51000 : 102 = 500 (mol)
Phương trình hoá học:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Theo phương trình hoá học có:
nAl2(SO4)3=nAl2O3 = 500 (mol)
Khối lượng Al2(SO4)3 tạo thành là:
m = 500 × [27 × 2 + (32 + 16 × 4) × 3] = 171000 gam = 171 kg.
Lời giải chi tiết:
Đổi 51 kg = 51000 gam.
nAl2O3 = 51000 : 102 = 500 (mol)
Phương trình hoá học:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Theo phương trình hoá học có:
nAl2(SO4)3=nAl2O3 = 500 (mol)
Khối lượng Al2(SO4)3 tạo thành là:
m = 500 × [27 × 2 + (32 + 16 × 4) × 3] = 171000 gam = 171 kg.
CH tr 59 MĐ
Thạch anh, đá khô, hồng ngọc đều do các oxide tạo nên. Vậy oxide là gì? Oxide có những tính chất hoá học như thế nào?
Lời giải chi tiết:
- Oxide là hợp chất của oxygen với một nguyên tố khác.
- Tính chất hoá học của oxide:
+ Oxide base tác dụng với dung dịch acid tạo thành muối và nước.
+ Oxide acid tác dụng với dung dịch base tạo thành muối và nước.
CH tr 59 CH1
Trong các chất sau đây, chất nào là oxide: Na2SO4, P2O5, CaCO3, SO2?
Phương pháp giải:
Dựa vào khái niệm oxide để trả lời câu hỏi
Oxide là hợp chất oxygen với 1 nguyên tố khác
Lời giải chi tiết:
Oxide là hợp chất của oxygen với một nguyên tố khác.
Vậy các oxide trong dãy là: P2O5, SO2.
CH tr 59 LT1
Viết các phương trình hoá học xảy ra giữa oxygen và các đơn chất để tạo ra các oxide sau: SO2, CuO, CO2, Na2O.
Phương pháp giải:
Dựa vào tính chất hóa học của oxide và oxygen để trả lời câu hỏi
Lời giải chi tiết:
Các phương trình hoá học xảy ra:
S + O2 → SO2
2Cu + O2 → 2CuO
C + O2 → CO2
4Na + O2 → 2Na2O.
CH tr 60 CH2
Các oxide sau đây thuộc những loại oxide nào (oxide base, oxide acid, oxide lưỡng tính, oxide trung tính): Na2O, Al2O3, SO3, N2O.
Phương pháp giải:
Dựa vào khái niệm oxide base và oxide acid để trả lời câu hỏi
Lời giải chi tiết:
- Oxide base là những oxide tác dụng được với dung dịch acid tạo thành muối và nước. Vậy Na2O là oxide base. Phương trình hoá học minh hoạ:
Na2O + 2HCl → 2NaCl + H2O.
- Oxide acid là những oxide tác dụng được với dung dịch base tạo thành muối và nước.
Vậy SO3 là oxide acid. Phương trình hoá học minh hoạ:
SO3 + 2NaOH → Na2SO4 + H2O.
- Oxide lưỡng tính là những oxide tác dụng với dung dịch acid và tác dụng với dung dịch base tạo thành muối và nước.
Vậy Al2O3 là oxide lưỡng tính. Phương trình hoá học minh hoạ:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O.
- Oxide trung tính là những oxide không tác dụng với dung dịch acid, dung dịch base.
Vậy N2O là oxide trung tính.
CH tr 60 TH1
Chuẩn bị
● Dụng cụ: Ống nghiệm, giá để ống nghiệm, thìa thuỷ tinh, ống hút nhỏ giọt.
● Hoá chất: CuO, dung dịch HCl loãng.
Tiến hành
● Lấy một lượng nhỏ CuO cho vào ống nghiệm, cho tiếp vào ống nghiệm khoảng 1 – 2 ml dung dịch HCl, lắc nhẹ.
● Mô tả các hiện tượng xảy ra.
● Dấu hiệu nào chứng tỏ có xảy ra phản ứng hoá học giữa CuO và dung dịch HCl?
Phương pháp giải:
Quan sát thí nghiệm thực hiện để trả lời câu hỏi
Lời giải chi tiết:
- Hiện tượng: CuO tan dần, thu được dung dịch có màu xanh.
- Dấu hiệu chứng tỏ có phản ứng hoá học xảy ra: CuO tan dần, dung dịch sau phản ứng có màu xanh.
CH tr 60 LT2
Viết phương trình hoá học giữa các cặp chất sau:
a) H2SO4 với MgO.
b) H2SO4 với CuO.
c) HCl với Fe2O3.
Phương pháp giải:
Oxide + acid → muối + nước
Lời giải chi tiết:
Các phương trình hoá học xảy ra:
a) H2SO4 + MgO → MgSO4 + H2O
b) H2SO4 + CuO → CuSO4 + H2O
c) 6HCl + Fe2O3 → 2FeCl3 + 3H2O.
CH tr 61 CH3
Viết các phương trình hoá học xảy ra khi cho dung dịch KOH phản ứng với các chất sau: SO2, CO2 và SO3.
Phương pháp giải:
Dựa vào tính chất hóa học của oxid
Oxide acid + Base → Muối
Lời giải chi tiết:
Các phương trình hoá học xảy ra:
2KOH + SO2 → K2SO3 + H2O
2KOH + CO2 → K2CO3 + H2O
2KOH + SO3 → K2SO4 + H2O.
CH tr 61 TH2
Chuẩn bị
● Dụng cụ: Bình tam giác (loại 100 ml), ống thuỷ tinh, ống nối cao su.
● Hoá chất: Dung dịch nước vôi trong, CO2 (được điều chế từ bình tạo khí CO2).
Tiến hành
● Cho vào bình tam giác khoảng 30 ml nước vôi trong, dẫn khí CO2 từ từ vào dung dịch, khi dung dịch vẩn đục thì dừng lại.
● Mô tả hiện tượng xảy ra, giải thích.
Phương pháp giải:
Thực hiện thí nghiệm, quan sát sau đó trả lời câu hỏi
Lời giải chi tiết:
- Hiện tượng: Xuất hiện chất không tan trong nước (chất kết tủa) màu trắng.
- Giải thích: CO2 đã phản ứng với dung dịch Ca(OH)2 tạo ra CaCO3 kết tủa theo phương trình hoá học sau: CO2 + Ca(OH)2 → CaCO3↓ + H2O.
CH tr 55 MĐ
pH là một trong những tiêu chí quan trọng để xác định chất lượng của nước sinh hoạt, lựa chọn đất cho cây trồng. Khi kiểm tra sức khoẻ, người ta cũng xem xét đến pH của máu và nước tiểu. Vậy chỉ số pH có ý nghĩa như thế nào? Để hiểu điều đó cần tìm hiểu về thang pH.
Lời giải chi tiết:
pH có ý nghĩa to lớn trong thực tiễn. Nhiều quá trình hoá học trong tự nhiên, trong sản xuất và trong cơ thể sống diễn ra trong điều kiện pH ổn định, một sự thay đổi đáng kể về pH có thể dẫn tới những ảnh hưởng không mong muốn tới các quá trình này. Do đó cần phải quan tâm đến pH của môi trường nước, môi trường đất để có biện pháp can thiệp kịp thời nhằm duy trì được pH tối ưu đối với đời sống của người, động vật, thực vật.
CH tr 55 CH1
Dung dịch X làm quỳ tím chuyển sang màu đỏ. Kết luận nào sau đây là đúng? Giải thích.
a) Dung dịch X có pH nhỏ hơn 7.
b) Dung dịch X có pH lớn hơn 7.
Phương pháp giải:
Dựa vào thang pH để trả lời câu hỏi.
Lời giải chi tiết:
Kết luận đúng là a) Dung dịch X có pH nhỏ hơn 7.
Giải thích: Vì dung dịch X làm quỳ tím chuyển sang màu đỏ nên dung dịch X có môi trường acid, do đó pH của dung dịch X nhỏ hơn 7.
CH tr 57 VD1
Trong sản xuất nông nghiệp, người ta thường bón vôi cho các ruộng bị chua. Theo em, sau khi bón vôi cho ruộng, pH của môi trường sẽ tăng lên hay giảm đi? Giải thích.
Phương pháp giải:
Dựa vào giá trị thanh pH để trả lời câu hỏi.
Lời giải chi tiết:
Ruộng bị chua là ruộng có môi trường acid, pH < 7. Ruộng càng chua thì pH càng thấp. Khi bón vôi cho ruộng, vôi sẽ trung hoà acid làm cho pH của môi trường tăng lên.
CH tr 57 TH
Xác định pH của các dung dịch giấm ăn, nước xà phòng, nước vôi trong
Chuẩn bị
● Dụng cụ: Mặt kính đồng hồ, ống hút nhỏ giọt.
● Hoá chất: Chất chỉ thị màu, các dung dịch giấm ăn, nước xà phòng, nước vôi trong.
Tiến hành
● Đặt giấy chỉ thị lên mặt kính đồng hồ, nhỏ một giọt dung dịch giấm ăn lên giấy.
● So màu của giấy chỉ thị sau khi nhỏ giấm ăn với thang màu pH tương ứng và ghi lại giá trị.
● Làm tương tự đối với dung dịch nước xà phòng và nước vôi trong.
● Kết quả xác định pH cho biết điều gì?
● Báo cáo kết quả xác định pH của các dung dịch theo gợi ý sau:
Dung dịch
Giấm ăn
Nước xà phòng
Nước vôi trong
pH
?
?
?
Phương pháp giải:
Thực hiện thí nghiệm, quan sát để trả lời câu hỏi
Lời giải chi tiết:
- Học sinh làm thí nghiệm và báo cáo kết quả xác định pH. Tham khảo kết quả sau:
Dung dịch
Giấm ăn
Nước xà phòng
Nước vôi trong
pH
3
8
11
- Kết quả xác định pH cho biết dung dịch là acid, base hay trung tính. Ngoài ra, kết quả này còn cho biết mức độ acid, base của dung dịch.
CH tr 58 VD2
Xác định pH của một số loại nước ép trái cây và ghi lại kết quả theo gợi ý sau:
Nước ép
Chanh
Cam
Táo
Dưa hấu
pH
?
?
?
?
Phương pháp giải:
Quan sát thí nghiệm để trả lời câu hỏi
Lời giải chi tiết:
Học sinh làm thí nghiệm và xác định.
Tham khảo kết quả bảng sau:
Nước ép
Chanh
Cam
Táo
Dưa hấu
pH
2
3
3,5
9
CH tr 58 VD3
Xác định pH của một số đồ uống khác và ghi kết quả theo gợi ý sau:
Đồ uống
Bia
Nước uống có gas
Sữa tươi
pH
?
?
?
Phương pháp giải:
Thực hiện thí nghiệm quan sát và trả lời câu hỏi
Lời giải chi tiết:
Học sinh làm thí nghiệm và xác định.
Tham khảo kết quả bảng sau:
Đồ uống
Bia
Nước uống có gas
Sữa tươi
pH
4
3
6
CH tr 58 CH
Tìm hiểu sự đổi màu của nước bắp cải tím khi tác dụng với các dung dịch acid và base
Xay bắp cải tím với nước, lọc bã qua rây để giữ lại nước lọc. Cho nước lọc thu được ở trên vào bốn cốc thuỷ tinh không màu có đánh số từ 1 đến 4, sau đó thêm vào các cốc:
● Cốc 1: nước vắt từ quả chanh.
● Cốc 2: dung dịch nước rửa bát (chén).
● Cốc 3: nước xà phòng.
● Cốc 4: giấm ăn.
Quan sát hiện tượng xảy ra và nhận xét.
Phương pháp giải:
Thực hiện thí nghiệm theo yêu cầu và quan sát để trả lời câu hỏi
Lời giải chi tiết:
Ban đầu nước ép bắp cải tím có màu tím.
- Cốc 1: thêm vào nước vắt từ quả chanh thấy dung dịch chuyển màu đỏ tím.
- Cốc 2: thêm vào dung dịch nước rửa chén (bát) thấy dung dịch chuyển màu xanh vàng.
- Cốc 3: thêm vào nước xà phòng thấy dung dịch chuyển màu xanh vàng.
- Cốc 4: thêm vào giấm ăn thấy dung dịch chuyển màu đỏ tím.
Nhận xét: Nước ép bắp cải tím có nhiều màu sắc phụ thuộc vào pH. Có thể dùng nước ép bắp cải tím như một chất chỉ thị màu để xác định một cách định tính môi trường dung dịch.
CH tr 51 MĐ
Để tránh nguyên liệu bị nát vụn khi chế biến, trong quá trình làm mứt người ta thường ngâm nguyên liệu vào nước vôi trong. Trong quá trình đó, độ chua của một số loại quả sẽ giảm đi. Vì sao lại như vây?
Phương pháp giải:
Dựa vào tính chất của base để trả lời câu hỏi.
Lời giải chi tiết:
Nước vôi trong có tính kiềm sẽ tác dụng với acid trong các loại quả làm cho độ chua của một số loại quả sẽ giảm đi.
CH tr 51 CH1
Trong các chất sau đây, những chất nào là base: Cu(OH)2, MgSO4, NaCl, Ba(OH)2?
Phương pháp giải:
Dựa vào khái niệm base
Base là những hợp chất trong phân tử có nguyên tử kim loại liên kết với nhóm hydroxide, khi tan trong nước base tạo ra ion OH-
Lời giải chi tiết:
Base là những hợp chất trong phân tử có nguyên tử kim loại liên kết với nhóm hydroxide. Khi tan trong nước, base tạo ra ion OH−.
Vậy những chất là base là: Cu(OH)2, Ba(OH)2.
CH tr 52 LT1
Dựa vào bảng tính tan, cho biết những base nào dưới đây là kiềm: KOH, Fe(OH)2, Ba(OH)2, Cu(OH)2.
Phương pháp giải:
Dựa vào phân loại của base để trả lời câu hỏi
Lời giải chi tiết:
Base tan trong nước còn được gọi là kiềm.
Vậy các base kiềm là: KOH; Ba(OH)2.
CH tr 52 TH1
Chuẩn bị:
● Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt, mặt kính đồng hồ.
● Hoá chất: Dung dịch NaOH loãng, giấy quỳ tím, dung dịch phenolphthalein.
Tiến hành:
● Đặt giấy quỳ tím lên mặt kính đồng hồ, lấy khoảng 1 ml dung dịch NaOH cho vào ống nghiệm.
● Nhỏ một giọt dung dịch NaOH lên mẩu giấy quỳ tím, nhỏ một giọt dung dịch phenolphthalein vào ống nghiệm có dung dịch NaOH.
● Mô tả các hiện tượng xảy ra.
Phương pháp giải:
Thực hành thí nghiệm sau đó quan sát thí nghiệm để trả lời câu hỏi.
Lời giải chi tiết:
Hiện tượng:
- Nhỏ một giọt dung dịch NaOH lên mẩu giấy quỳ tím thấy mẩu giấy quỳ tím chuyển sang màu xanh.
- Nhỏ một giọt dung dịch phenolphthalein vào ống nghiệm có dung dịch NaOH thấy dung dịch trong ống nghiệm chuyển sang màu hồng.
CH tr 52 LT2
Có hai dung dịch giấm ăn và nước vôi trong. Nêu cách phân biệt hai dung dịch trên bằng:
a) quỳ tím.
b) phenolphthalein.
Phương pháp giải:
Dựa vào tính chất hóa học của acid và base để trả lời câu hỏi
Lời giải chi tiết:
a) Cách phân biệt hai dung dịch giấm ăn và nước vôi trong bằng quỳ tím:
- Đánh số thứ tự các lọ đựng dung dịch, trích mỗi lọ dung dịch một ít vào ống nghiệm đánh số tương ứng (trích mẫu thử).
- Cho vào mỗi mẫu thử một mẩu quỳ tím.
+ Nếu quỳ tím chuyển sang màu xanh → dung dịch nước vôi trong.
+ Nếu quỳ tím chuyển sang màu đỏ → dung dịch giấm ăn.
b) Cách phân biệt hai dung dịch giấm ăn và nước vôi trong bằng phenolphthalein:
- Đánh số thứ tự các lọ đựng dung dịch, trích mỗi lọ dung dịch một ít vào ống nghiệm đánh số tương ứng (trích mẫu thử).
- Cho vào mỗi mẫu thử một vài giọt phenolphthalein:
+ Nếu dung dịch trong ống nghiệm chuyển sang màu hồng → dung dịch nước vôi trong.
+ Nếu dung dịch trong ống nghiệm không đổi màu → dung dịch giấm ăn.
CH tr 53 TH2
Chuẩn bị:
● Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt.
● Hoá chất: Dung dịch NaOH loãng, dung dịch HCl loãng, dung dịch phenolphthalein.
Tiến hành:
● Cho khoảng 1 ml dung dịch NaOH vào ống nghiệm, thêm tiếp một giọt dung dịch phenolphthalein và lắc nhẹ.
● Nhỏ từ từ dung dịch HCl loãng vào ống nghiệm đến khi dung dịch trong ống nghiệm mất màu thì dừng lại.
● Mô tả các hiện tượng xảy ra.
● Giải thích sự thay đổi màu của dung dịch trong ống nghiệm trong quá trình thí nghiệm.
Phương pháp giải:
Thực hiện thí nghiệm và sau đó quan sát thí nghiệm xảy ra để trả lời câu hỏi
Lời giải chi tiết:
- Hiện tượng:
+ Thêm một giọt dung dịch phenolphthalein vào ống nghiệm đựng dung dịch NaOH thấy dung dịch trong ống nghiệm chuyển sang màu hồng.
+ Nhỏ từ từ dung dịch HCl loãng vào ống nghiệm thấy màu hồng của dung dịch trong ống nghiệm nhạt dần đến mất màu.
- Giải thích:
NaOH tác dụng với HCl theo phương trình hoá học:
NaOH + HCl → NaCl + H2O.
Dung dịch sau phản ứng chứa NaCl và HCl dư nên không làm đổi màu phenolphthalein.
CH tr 53 TH3
Chuẩn bị:
● Dụng cụ: Giá để ống nghiệm, ống nghiệm, ống hút nhỏ giọt, thìa thuỷ tinh.
● Hoá chất: Mg(OH)2 (được điều chế sẵn), dung dịch HCl, nước cất.
Tiến hành:
● Lấy một lượng nhỏ Mg(OH)2 cho vào ống nghiệm, thêm vào khoảng 1 ml nước cất, lắc nhẹ.
● Tiếp tục nhỏ từ từ dung dịch HCl vào ống nghiệm đến khi không nhìn thấy chất rắn trong ống nghiệm thì dừng lại.
● Mô tả các hiện tượng xảy ra.
● Giải thích các hiện tượng diễn ra trong quá trình thí nghiệm.
Phương pháp giải:
Quan sát thí nghiệm để trả lời câu hỏi
Lời giải chi tiết:
- Hiện tượng: Mg(OH)2 không tan trong nước nhưng tan trong dung dịch HCl.
- Giải thích: Mg(OH)2 tác dụng với HCl để tạo thành muối tan theo phương trình hoá học:
Mg(OH)2 + 2HCl → MgCl2 + 2H2O.
CH tr 54 LT3
Viết các phương trình hoá học xảy ra khi cho các base: KOH, Cu(OH)2, Mg(OH)2 lần lượt tác dụng với:
a) dung dịch HCl.
b) dung dịch H2SO4.
Phương pháp giải:
Acid + base → muối + H2O
Lời giải chi tiết:
Các phương trình hoá học xảy ra:
a) KOH + HCl → KCl + H2O
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Mg(OH)2 + 2HCl → MgCl2 + 2H2O.
b) 2KOH + H2SO4 → K2SO4 + 2H2O
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O.
CH tr 54 LT4
Hoàn thành các phương trình hoá học theo sơ đồ sau:
a) KOH + ? → K2SO4 + H2O
b) Mg(OH)2 + ? → MgSO4 + H2O
c) Al(OH)3 + H2SO4 → ? + ?
Phương pháp giải:
Dựa vào tính chất hóa học của base để trả lời câu hỏi
Base + acid → muối + nước
Lời giải chi tiết:
a) 2KOH + H2SO4 → K2SO4 + 2H2O
b) Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
c) 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O.
CH tr 54 VD
Một loại thuốc dành cho bệnh nhân đau dạ dày có chứa Al(OH)3 và Mg(OH)2. Viết phương trình hoá học xảy ra giữa acid HCl có trong dạ dày với các chất trên.
Phương pháp giải:
Base + Acid → Muối + Nước
Lời giải chi tiết:
Các phương trình hoá học xảy ra:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Mg(OH)2 + 2HCl → MgCl2 + 2H2O