Chuyên đề KHTN 8 Cánh diều bài 11 Oxide được soạn dưới dạng file word và PDF gồm 6 trang. Các bạn xem và tải về ở dưới.
BÀI 11: OXIDE
A. TÓM TẮT LÝ THUYẾT
I. KHÁI NIỆM OXIDE
Oxide là hợp chất của oxygen với một nguyên tố khác.
Ví dụ: Al2O3 (aluminium oxide), CO2 (carbon dioxide), SiO2 (silicon dioxide), CuO (copper(II) oxide), P2O5 (phosphor pentoxide), NO2 (nitrogen dioxide), N2O5( dinitrogen pentoxide),…
II. PHÂN LOẠI OXIDE
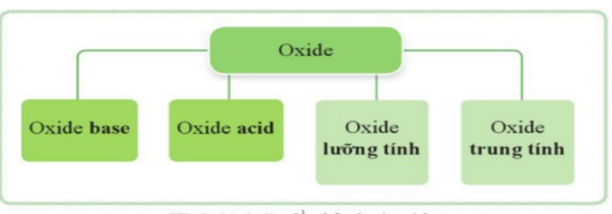
Dựa vào khả năng phản ứng với acid và base, oxide được phân chia thành bốn loại:
+ Oxide base (basic oxides) là những oxide tác dụng với dung dịch acid tạo thành muối và nước.
Ví dụ: CuO (copper(II) oxide), CaO (calcium oxide), MgO, Na2O (Sodium oxide), K2O, BaO, FeO,…
+ Oxide acid (acidic oxides) là những oxide tác dụng với dung dịch base tạo thành muối và nước.
Ví dụ: CO2, SO2, SO3, P2O5, NO2, N2O5,…
+ Oxide lưỡng tính (amphoteric oxides) là những oxide tác dụng với dung dịch acid và dung dịch base tạo thành muối và nước
Ví dụ: Al2O3, ZnO, Cr2O3….
+ Oxide trung tính (neutral oxides) là những oxide không tác dụng với dung dịch acid và dung dịch base
Ví dụ: CO, NO, N2O, …
1. Oxide base (basic oxide)
Oxide base tác dụng với dung dịch acid tạo ra muối và nước.
Ví dụ: CuO + HCl → CuCl2 + H2O
2. Oxide acid (acidic oxide)
Oxide acid tác dụng với dung dịch base tạo ra muối và nước.
Ví dụ: CO2 + Ca(OH)2 → CaCO3 + H2O
B. CÂU HỎI TRONG BÀI HỌC
Câu 1. [CD – SGK trang 59]: Trong các chất sau đây, chất nào là oxide: Na2SO4, P2O5, CaCO3, SO2?
Hướng dẫn giải
Chất oxide trong dãy là: P2O5, SO2.
Câu 2. [CD – SGK trang 54]: Viết các phương trình hoá học xảy ra giữa oxygen và các đơn chất để tạo ra các oxide sau: SO2, CuO, CO2, Na2O.
Hướng dẫn giải
Các phương trình hóa học xảy ra:
$S + {O_2}\xrightarrow{{{t^0}}}S{O_2}$
$ 2Cu + {O_2}\xrightarrow{{{t^0}}}2CuO$
$C + {O_2}\xrightarrow{{{t^0}}}C{O_2}$
$ 4Na + {O_2}\xrightarrow{{{t^0}}}2N{a_2}O$
Câu 3. [CD – SGK trang 60]: Các oxide sau đây thuộc những loại oxide nào (oxide base, oxide acid, oxide lưỡng tính, oxide trung tính): Na2O, Al2O3, SO3, N2O.
Hướng dẫn giải
– Oxide base là những oxide tác dụng được với dung dịch acid tạo thành muối và nước. Vậy Na2O là oxide base.
Phương trình hoá học minh hoạ:
$N{a_2}O + 2HCl \to 2NaCl + {H_2}O$
– Oxide acid là những oxide tác dụng được với dung dịch base tạo thành muối và nước. Vậy SO3 là oxide acid.
Phương trình hoá học minh hoạ:
$S{O_3} + 2NaOH \to N{a_2}S{O_4} + {H_2}O$
– Oxide lưỡng tính là những oxide tác dụng với dung dịch acid và tác dụng với dung dịch base tạo thành muối và nước. Vậy Al2O3 là oxide lưỡng tính.
Phương trình hoá học minh hoạ:
$\begin{gathered}
A{l_2}{O_3} + 6HCl \to 2AlC{l_3} + 3{H_2}O \hfill \\
A{l_2}{O_3} + 2NaOH \to 2NaAl{O_2} + {H_2}O \hfill \\
\end{gathered} $
– Oxide trung tính là những oxide không tác dụng với dung dịch acid, dung dịch base. Vậy N2O là oxide trung tính.
Câu 4. [CD – SGK trang 60]: Viết phương trình hoá học giữa các cặp chất sau:
a) H2SO4 với MgO.
b) H2SO4 với CuO.
c) HCl với Fe2O3.
Hướng dẫn giải
a) ${H_2}S{O_4} + MgO \to MgS{O_4} + {H_2}O$
b) ${H_2}S{O_4} + CuO \to CuS{O_4} + {H_2}O$
c) $6HCl + F{e_2}{O_3} \to 2FeC{l_3} + 3{H_2}O$
Câu 5. [CD – SGK trang 60]: Viết các phương trình hoá học xảy ra khi cho dung dịch KOH phản ứng với các chất sau: SO2, CO2 và SO3.
Hướng dẫn giải
$\begin{gathered}
KOH + S{O_2}\xrightarrow{{}}{K_2}S{O_3} + {H_2}O \hfill \\
2KOH + C{O_2}\xrightarrow{{}}{K_2}C{O_3} + {H_2}O \hfill \\
2KOH + S{O_3}\xrightarrow{{}}{K_2}S{O_4} + {H_2}O \hfill \\
\end{gathered} $
C. CÂU HỎI CUỐI BÀI HỌC
(KHÔNG CÓ)
D. TỰ LUẬN
Câu 1: Trong các chất sau đây, chất nào là oxide: P2O5, NaOH, CO2, ZnCl2, K2O, SO3, FeSO4, CO, CuO, BaO, H2SO4, PbCl2?
Hướng dẫn giải
Chất oxide trong dãy là: P2O5, CO2, K2O, SO3, CO, CuO, BaO.
Câu 2: Vì sao tại các kho chứa than tổ ong không được sắp xếp than thành những đống lớn?

Hướng dẫn giải
Do than (C) tác dụng chậm với O2 trong không khí tạo ra CO2, phản ứng tỏa nhiệt. Nhiệt tỏa ra được tích góp dần, khi đạt tới nhiệt độ cháy thì than sẽ tự bốc cháy.
 Câu 3: Mưa axit là hàm lượng nước mưa có chứa hàm lượng axit cao hơn bình thường. Mưa axit ảnh hưởng đến đất đai, cây trồng, các công trình xây dựng. Nguyên nhân gây ra mưa axit là do hoạt động sản xuất công nghiệp, từ phương tiện giao thông quá trình phun trào núi lửa, cháy rừng… sản sinh ra các khí gây hiện tượng mưa axit. Thành phần chính của mưa acid là một số oxide. Vậy đó là những oxide nào?
Câu 3: Mưa axit là hàm lượng nước mưa có chứa hàm lượng axit cao hơn bình thường. Mưa axit ảnh hưởng đến đất đai, cây trồng, các công trình xây dựng. Nguyên nhân gây ra mưa axit là do hoạt động sản xuất công nghiệp, từ phương tiện giao thông quá trình phun trào núi lửa, cháy rừng… sản sinh ra các khí gây hiện tượng mưa axit. Thành phần chính của mưa acid là một số oxide. Vậy đó là những oxide nào?
Hướng dẫn giải
Thành phần chính của mưa acid là oxide NO2, SO2.
 Câu 4: Trong sản xuất rượu vang, oxide nào được dùng làm chất chống oxi hóa, ức chế một số loại vi khuẩn, do đó có thể lưu trữ rượu được lâu hơn. Tuy nhiên, lượng oxide có trong rượu phải được kiểm soát một cách nghiêm ngặt để không làm ảnh hưởng đến sức khỏe người sử dụng.
Câu 4: Trong sản xuất rượu vang, oxide nào được dùng làm chất chống oxi hóa, ức chế một số loại vi khuẩn, do đó có thể lưu trữ rượu được lâu hơn. Tuy nhiên, lượng oxide có trong rượu phải được kiểm soát một cách nghiêm ngặt để không làm ảnh hưởng đến sức khỏe người sử dụng.
Hướng dẫn giải
Oxide được dùng làm chất chống oxi hóa, ức chế một số loại vi khuẩn, do đó có thể lưu trữ rượu được lâu hơn là SO2.
Câu 5: Viết các phương trình hoá học xảy ra khi cho dung dịch HCl phản ứng với các chất sau: Na2O, CaO, MgO, Fe2O3
Hướng dẫn giải
$2HCl + N{a_2}O \to 2NaCl + {H_2}O$
$ 2HCl + CaO \to CaC{l_2} + {H_2}O$
$2HCl + MgO \to MgC{l_2} + {H_2}O$
$ 6HCl + F{e_2}{O_3} \to 2FeC{l_3} + 3{H_2}O$
E. BÀI TẬP TRẮC NGHIỆM
MỨC ĐỘ 1: BIẾT (7 câu biết)
Câu 1. Oxide là
A. Hỗn hợp các nguyên tố oxygen với một số nguyên tố hóa học khác.
B. Hợp chất của nguyên tố phi kim với một nguyên tố hóa học khác.
C. Hợp chất của oxygen với một nguyên tố hóa học khác.
D. Hợp chất của nguyên tố kim loại với một nguyên tố hóa học khác.
Câu 2. Oxide base là
A. Những oxide tác dụng với dung dịch acid tạo thành muối và nước.
B. Những oxide tác dụng với dung dịch base tạo thành muối và nước.
C. Những oxide không tác dụng với dung dịch base và dung dịch acid.
D. Những oxide chỉ tác dụng được với muối.
Câu 3. Oxide acid là
A. Những oxide tác dụng với dung dịch acid tạo thành muối và nước.
B. Những oxide tác dụng với dung dịch base tạo thành muối và nước.
C. Những oxide không tác dụng với dung dịch base và dung dịch acid.
D. Những oxide chỉ tác dụng được với muối.
Câu 4. Oxide lưỡng tính là
A. Những oxide tác dụng với dung dịch acid tạo thành muối và nước.
B. Những oxide tác dụng với dung dịch base tạo thành muối và nước.
C. Những oxide tác dụng với dung dịch base và dung dịch acid.
D. Những oxide chỉ tác dụng được với muối.
Câu 5. Oxide nào sau đây là oxide acid?
A. SO2. B. Na2O. C. Al2O3. D. CO.
Câu 6. Oxide nào sau đây là oxide lưỡng tính?
A. SO2. B. Na2O. C. Al2O3. D. CO.
Câu 7. Oxide nào sau đây là oxide trung tính?
A. SO2. B. Na2O. C. Al2O3. D. CO.
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 | 6 | 7 |
| C | A | B | C | A | C |
D |
 MỨC ĐỘ 2: HIỂU (5 câu)
MỨC ĐỘ 2: HIỂU (5 câu)
Câu 8. Một oxide được sử dụng phần lớn để sản xuất H2SO4. Ngoài ra, oxide đó còn được dùng để tẩy trắng bột gỗ trong công nghiệp giấy, làm chất diệt nấm mốc. Oxide đó là
A. SO2. B. BaO.
C. Al2O3. D. MgO.
 Câu 9. Khi sản xuất nước ngọt có gas người ta thường nén khí của oxide nào ở áp suất cao để tăng khả năng hòa tan của oxide đó trong nước
Câu 9. Khi sản xuất nước ngọt có gas người ta thường nén khí của oxide nào ở áp suất cao để tăng khả năng hòa tan của oxide đó trong nước
A. SO2. B. CO2.
C. Cr2O3. D. CaO.
 Câu 10. Bóng cười (Funkyball hoặc Hippycrack) hay còn gọi là khí gây cười là một chất khí không màu, không mùi. Khi người dùng hít vào cho cảm giác hưng phấn, vui vẻ. Bên cạnh đó, người dùng gặp ảo giác và các triệu chứng đau đầu, nôn, mệt mỏi, rùng mình,…Thành phần chính của bóng cười là oxide
Câu 10. Bóng cười (Funkyball hoặc Hippycrack) hay còn gọi là khí gây cười là một chất khí không màu, không mùi. Khi người dùng hít vào cho cảm giác hưng phấn, vui vẻ. Bên cạnh đó, người dùng gặp ảo giác và các triệu chứng đau đầu, nôn, mệt mỏi, rùng mình,…Thành phần chính của bóng cười là oxide
A. NO2. B. N2O.
C. NO. D. CO.
Câu 11. Dãy chất gồm các oxide acid là
A. CO2, SO2, NO, P2O5. B. CO2, SO2, Na2O, NO2.
C. SO2, P2O5, CO2, SO3. D. H2O, CO, NO, Al2O3.
Câu 12. Dãy chất gồm các oxide base là
A. CuO, NO, MgO, CaO. B. CuO, CaO, MgO, Na2O.
C. CaO, CO2, K2O, Na2O. D. K2O, FeO, P2O5, Mn2O7.
ĐÁP ÁN
|
8 |
9 | 10 | 11 | 12 |
| A | A | B | C |
B |
MỨC ĐỘ 3: VẬN DỤNG (GIẢI CHI TIẾT) 3 câu
Câu 13. Trên bề mặt của vỏ trứng gia cầm có những lỗ nhỏ nên vi khuẩn có thể xâm nhập được và hơi nước, cacbonđioxit có thể thoát ra làm trứng hỏng nhanh chóng. Để bảo quản trứng người ta thường nhúng vào dung dịch Ca(OH)2. Phản ứng hóa học nào xảy ra trong quá trình này?

A. CaO + H2O → Ca(OH)2. B. Ca(OH)2 + 2CO2 → Ca(HCO3)2.
C. CaCO3 + CO2 + H2O → Ca(HCO3)2. D. Ca(OH)2 + CO2 → CaCO3 + H2O.
Chọn D
Câu 14. Một oxide của sulfur có thành phần phần trăm của O bằng 50%. Biết oxide này có khối lượng mol phân tử là 64 gam/mol. Công thức hóa học của oxide là
A. SO2. B. SO. C. SO3. D. SO4.
Hướng dẫn giải
Công thức hóa học của oxide có dạng SxOy
${M_{{S_x}{O_y}}} = x{M_S} + y{M_O} = 32x + 16y = 64$
$ \to \% {m_S} = \frac{{32x}}{{64}} = 50\% $
$ \to x = 1,\quad y = 2$
Chọn A
Câu 15. Hòa tan 23,5 gam potassium oxide (K2O) vào 250 ml HCl thu được KCl và H2O. Nồng độ mol của HCl là
A. 1M. B. 2M. C. 0,5M. D. 1,5M.
Hướng dẫn giải
${n_{{K_2}O}} = \frac{{23,5}}{{94}} = 0,25{\kern 1pt} \;(mol)$
PTHH
$\begin{gathered}
{K_2}O\quad + \quad 2HCl\quad \xrightarrow{{}}\quad 2KCl + {H_2}O \hfill \\\end{gathered} $
0,25 → 0,5(mol)
${n_{HCl}} = 2{n_{{K_2}O}} = 2.0,25 = 0,5\;(mol)$
${C_{HCl}} = \frac{{0,5}}{{0,25}} = 2\;(M)$
Chọn B