Chuyên đề KHTN 8 Cánh diều bài 12 Muối được soạn dưới dạng file word và PDF gồm 9 trang. Các bạn xem và tải về ở dưới.
BÀI 12: MUỐI
SGK CÁNH DIỀU
A. TÓM TẮT LÝ THUYẾT
1. Khái niệm muối
Muối là những hợp chất được tạo ra khi thay thế ion${H^ + }$ trong acid bằng ion kim loại hoặc ion ammonium $(N{H_4}^ + )$.
2. Tên gọi của muối
Tên muối = tên kim loại (hoặc ammonium) + (hóa trị) + tên gốc muối
nếu kim loại có nhiều hóa trị
Ví dụ: K3PO4: Potassium phosphate
CuS: copper(II) sulfur
3. Tính tan của muối
Dựa vào khả năng tan trong nước, có thể chia muối thành 3 loại chính:
Muối tan tốt trong nước: NaCl, CuSO4, Ca(NO3)2.
Muối ít tan trong nước: CaSO4, PbCl2.
Muối không tan trong nước: CaCO3, BaSO4, AgCl.
4. Tính chất hóa học của muối
Tác dụng với kim loại:
Kim loại A + Muối kim loại B $ \to $ Muối kim loại B + Kim loại A
Tác dụng với base:
Muối + Base$\; \to $ Muối mới + Base mới
Tác dụng với acid:
Muối + Acid$\; \to $ Muối mới + Acid mới
Tác dụng với acid:
Muối A+ Muối B$\; \to $ Muối C + Muối D
5. Mối quan hệ giữa acid, base, oxide và muối
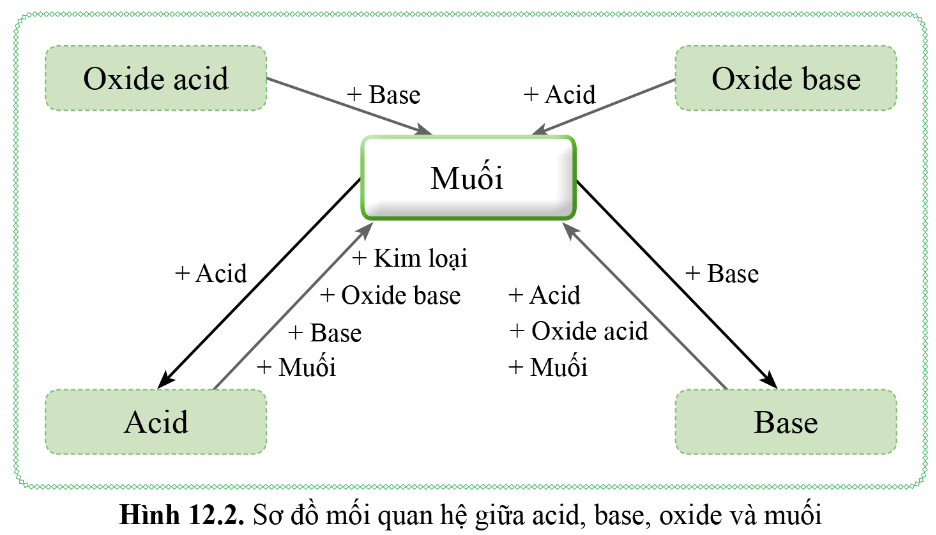
6. Một số phương pháp điều chế muối
Có thể điều chế muối từ:
Oxide acid
Oxide acid + Base $ \to $ Muối + H2O
Oxide base:
Oxide base + acid $ \to $ Muối + H2O
Dung dịch acid và base:
Base + Acid $ \to $ Muối + H2O
Kim loại và acid:
Kim loại M + Acid (HCl, H2SO4 loãng )$ \to $ Muối + H2
Muối tác dụng với muối khác:
Muối A+ Muối B$\; \to $ Muối C + Muối D
B. CÂU HỎI TRONG BÀI HỌC
Câu 1. [CD – SGK trang 63]: Cho biết các muối: Na3PO4, MgCl2, CaCO3, CuSO4, KNO3 tương ứng với acid nào trong số các acid sau: HCl, H2SO4, H3PO4, HNO3, H2CO3.
Hướng dẫn giải
| Muối | Na3PO4 | MgCl2 | CaCO3 | CuSO4 | KNO3 |
| Acid tương ứng | H3PO4 | HCl | H2CO3 | H2SO4 | HNO3 |
Câu 2. [CD – SGK trang 63]: Gọi tên các muối sau: KCl, ZnSO4, MgCO3, Ca3(PO4)2, Cu(NO3)2, Al2(SO4)3.
Hướng dẫn giải
| Công thức hóa học | Tên gọi |
| KCl | Potassium chloride |
| ZnSO4 | Zinc sulfate |
| MgCO3 | Magnesium carbonate |
| Ca3(PO4)2 | Calcium phosphate |
| Cu(NO3)2 | Copper(II) nitrate |
| Al2(SO4)3 | Aluminium sulfate |
Câu 3. [CD – SGK trang 64]: Sử dụng bảng tính tan, cho biết muối nào sau đây tan được trong nước: K2SO4, Na2CO3, AgNO3, KCl, CaCl2, BaCO3, MgSO4
Hướng dẫn giải
Các muối tan trong nước là: K2SO4, Na2CO3, AgNO3, KCl, CaCl2, MgSO4
Câu 4. [CD – SGK trang 64]: Dung dịch CuSO4 có màu xanh lam, dung dịch ZnSO4 không màu. Viết phương trình hoá học xảy ra khi ngâm Zn trong dung dịch CuSO4, dự đoán sự thay đổi về màu của dung dịch trong quá trình trên.
Hướng dẫn giải
– Phương trình hoá học xảy ra: Zn + CuSO4→ ZnSO4 + Cu.
– Dự đoán sự thay đổi màu của dung dịch: Dung dịch nhạt màu dần đến mất màu.
Câu 5. [CD – SGK trang 64]: Viết phương trình hoá học của phản ứng xảy ra trong các trường hợp sau:
a) Cho Fe vào dung dịch CuSO4.
b) Cho Zn vào dung dịch AgNO3.
Hướng dẫn giải
Phương trình hoá học xảy ra:
$a){\text{ }}Fe{\text{ }} + {\text{ }}CuS{O_4}\; \to {\text{ }}FeS{O_4} + {\text{ }}Cu \downarrow $
$b){\text{ }}Zn{\text{ }} + {\text{ }}2AgN{O_3} \to {\text{ }}Zn{\left( {N{O_3}} \right)_2}\; + {\text{ }}2Ag \downarrow $
Câu 6. [CD – SGK trang 65]: Dự đoán các hiện tượng xảy ra trong các thí nghiệm sau:
a) Nhỏ dung dịch H2SO4 loãng vào dung dịch Na2CO3.
b) Nhỏ dung dịch HCl loãng vào dung dịch AgNO3.
Giải thích và viết phương trình hoá học xảy ra (nếu có).
Hướng dẫn giải
a) Hiện tượng: có khí thoát ra.
Giải thích: H2SO4 loãng tác dụng với Na2CO3 sinh ra khí CO2 theo phương trình hoá học:
${H_2}S{O_4}\; + {\text{ }}N{a_2}C{O_3} \to {\text{ }}N{a_2}S{O_4}\; + {\text{ }}C{O_2} \uparrow {\text{ }} + {\text{ }}{H_2}O.$
b) Hiện tượng: xuất hiện kết tủa trắng.
Giải thích: HCl tác dụng với AgNO3 sinh ra kết tủa trắng là AgCl theo phương trình hoá học:
$HCl{\text{ }} + {\text{ }}AgN{O_3}\; \to {\text{ }}AgCl \downarrow {\text{ }} + {\text{ }}HN{O_3}.$
Câu 7. [CD – SGK trang 65]: Viết phương trình hoá học xảy ra trong các trường hợp sau:
a) Dung dịch FeCl3 tác dụng với dung dịch NaOH.
b) Dung dịch CuCl2 tác dụng với dung dịch KOH.
Hướng dẫn giải
$a){\text{ }}FeC{l_3}{\text{ }} + {\text{ }}3NaOH{\text{ }} \to {\text{ }}Fe{\left( {OH} \right)_3} \downarrow {\text{ }} + {\text{ }}3NaCl$
b) $CuC{l_2}{\text{ }} + {\text{ }}2KOH{\text{ }} \to {\text{ }}Cu{\left( {OH} \right)_2} \downarrow {\text{ }} + {\text{ }}2KCl.$
Câu 8. [CD – SGK trang 65]: Hoàn thành các phương trình hoá học theo các sơ đồ sau:
$a){\text{ }}MgO{\text{ }} + {\text{ }}?{\text{ }} \to {\text{ }}MgS{O_4}{\text{ }} + {\text{ }}{H_2}O$
$b){\text{ }}KOH{\text{ }} + {\text{ }}? \to {\text{ }}Cu{\left( {OH} \right)_2} \downarrow {\text{ }} + {\text{ }}?$
Hướng dẫn giải
$a){\text{ }}MgO{\text{ }} + {\text{ }}{H_2}SO4{\text{ }} \to {\text{ }}MgS{O_4}{\text{ }} + {\text{ }}{H_2}O$
$b){\text{ }}2KOH{\text{ }} + {\text{ }}CuC{l_2}{\text{ }} \to {\text{ }}Cu{\left( {OH} \right)_2} \downarrow {\text{ }} + {\text{ }}2KCl$
Câu 9. [CD – SGK trang 66]: Viết phương trình hoá học xảy ra giữa các dung dịch sau:
a) Dung dịch NaCl với dung dịch AgNO3.
b) Dung dịch Na2SO4 với dung dịch BaCl2.
c) Dung dịch K2CO3 với dung dịch Ca(NO3)2.
Hướng dẫn giải
$a){\text{ }}NaCl{\text{ }} + {\text{ }}AgN{O_3}{\text{ }} \to {\text{ }}AgCl \downarrow {\text{ }} + {\text{ }}NaN{O_3}.$
$b){\text{ }}N{a_2}S{O_4}{\text{ }} + {\text{ }}BaC{l_2}{\text{ }} \to {\text{ }}BaS{O_4} \downarrow {\text{ }} + {\text{ }}2NaCl$
$c){\text{ }}{K_2}C{O_3}{\text{ }} + {\text{ }}Ca{\left( {N{O_3}} \right)_2}{\text{ }} \to {\text{ }}CaC{O_3} \downarrow {\text{ }} + {\text{ }}2KN{O_3}.$
Câu 10. [CD – SGK trang 66]: Viết các phương trình hoá học theo sơ đồ chuyển hoá sau:
$CuO{\text{ }}\xrightarrow{{(1)}}CuS{O_4}{\text{ }}\xrightarrow{{(2)}}{\text{ }}CuC{l_2}{\text{ }}\xrightarrow{{(3)}}{\text{ }}Cu{\left( {OH} \right)_2}$
Hướng dẫn giải
Các phương trình hoá học theo sơ đồ:
$\begin{array}{*{20}{l}}
{\left( 1 \right){\text{ }}CuO{\text{ }} + {\text{ }}{H_2}S{O_4}{\text{ }} \to {\text{ }}CuS{O_4}{\text{ }} + {\text{ }}{H_2}O.} \\
{\left( 2 \right){\text{ }}CuS{O_4}{\text{ }} + {\text{ }}BaC{l_2}{\text{ }} \to {\text{ }}BaS{O_4} \downarrow {\text{ }} + {\text{ }}CuC{l_2}.} \\
{\left( 3 \right){\text{ }}CuC{l_2}{\text{ }} + {\text{ }}2NaOH{\text{ }} \to {\text{ }}Cu{{\left( {OH} \right)}_2} \downarrow {\text{ }} + {\text{ }}2NaCl.}
\end{array}$
Câu 11. [CD – SGK trang 67]: Viết ba phương trình hoá học khác nhau để tạo ra Na2SO4 từ NaOH.
Hướng dẫn giải
Ba phương trình hoá học khác nhau để tạo ra Na2SO4 từ NaOH là:
$\begin{array}{*{20}{l}}
{\left( 1 \right){\text{ }}2NaOH{\text{ }} + {\text{ }}S{O_3}{\text{ }} \to {\text{ }}N{a_2}S{O_4}{\text{ }} + {\text{ }}{H_2}O.} \\
{\left( 2 \right){\text{ }}2NaOH{\text{ }} + {\text{ }}{H_2}S{O_4}{\text{ }} \to {\text{ }}N{a_2}S{O_4}{\text{ }} + {\text{ }}2{H_2}O.} \\
{\left( 3 \right){\text{ }}2NaOH{\text{ }} + {\text{ }}CuS{O_4}{\text{ }} \to {\text{ }}N{a_2}S{O_4}{\text{ }} + {\text{ }}Cu{{\left( {OH} \right)}_2} \downarrow .}
\end{array}$
Câu 12. [CD – SGK trang 67]: Viết ba phương trình hoá học khác nhau để điều chế CuCl2.
Hướng dẫn giải
Ba phương trình hoá học khác nhau để điều chế CuCl2:
$\begin{array}{*{20}{l}}
{\left( 1 \right){\text{ }}CuO{\text{ }} + {\text{ }}2HCl{\text{ }} \to {\text{ }}CuC{l_2}{\text{ }} + {\text{ }}{H_2}O.} \\
{\left( 2 \right){\text{ }}Cu{{\left( {OH} \right)}_2}{\text{ }} + {\text{ }}2HCl{\text{ }} \to {\text{ }}CuC{l_2}{\text{ }} + {\text{ }}2{H_2}O.} \\
{\left( 3 \right){\text{ }}CuS{O_4}{\text{ }} + {\text{ }}BaC{l_2}{\text{ }} \to {\text{ }}CuC{l_2}{\text{ }} + {\text{ }}BaS{O_4} \downarrow .}
\end{array}$
Câu 13. [CD – SGK trang 67]: Muối Al2(SO4)3 được dùng trong công nghiệp để nhuộm vải, thuộc da, làm trong nước,… Tính khối lượng Al2(SO4)3 tạo thành khi cho 51 kg Al2O3 tác dụng hết với dung dịch H2SO4.
Hướng dẫn giải
Đổi 51 kg = 51 000 gam.
${n_{A{l_2}{O_3}}} = \frac{{51000}}{{102}} = 500{\text{ }}(mol)$
Phương trình hoá học:
$A{l_2}{O_3}{\text{ }} + {\text{ }}3{H_2}S{O_4}{\text{ }} \to {\text{ }}A{l_2}{\left( {S{O_4}} \right)_3}{\text{ }} + {\text{ }}3{H_2}O$
Theo phương trình hóa học có:
${n_{A{l_2}{{(S{O_4})}_3}}} = {n_{A{l_2}{O_3}}} = 500{\text{ (mol)}}$
Khối lượng Al2(SO4)3 tạo thành là:
m = 500 × [27 × 2 + (32 + 16 × 4) × 3] = 171 000 gam = 171 kg.
C. CÂU HỎI CUỐI BÀI HỌC
(KHÔNG CÓ)
D. TỰ LUẬN
Câu 1: Gọi tên các muối sau: NaF, CuCl2, CaSO3, Ba(HCO3)2, KHSO4
Hướng dẫn giải
NaF: sodium fluoride
CuCl2: copper (II) chloride
CaSO3: calcium sulfite
Ba(HCO3)2: barium hydrogen carbonate
KHSO4: potassium hydrogen sulfate
 Câu 2: Thạch nhũ trong hang động đá vôi được hình thành như thế nào?
Câu 2: Thạch nhũ trong hang động đá vôi được hình thành như thế nào?
Hướng dẫn giải
Nước mưa khí quyển có chứa CO2 sẽ hòa tan rất mạnh các khoáng vật thuộc nhóm carbonate chuyển thành calcium hydrogencarbonate (Ca(HCO3)2), hình thành các khối thạch nhũ theo công thức$CaC{O_3}\; + {\text{ }}C{O_2}\; + {\text{ }}{H_2}O{\text{ }} \to {\text{ }}Ca{\left( {HC{O_3}} \right)_2}$
 Câu 3: Tại sao thuốc muối chữa được bệnh đau dạ dày do ? Khi uống vào thường bị ợ hơi?
Câu 3: Tại sao thuốc muối chữa được bệnh đau dạ dày do ? Khi uống vào thường bị ợ hơi?
Hướng dẫn giải
Trong dạ dày, có chứa dung dịch HCl. Người bị đau dạ dày là người có nồng độ dung dịch HCl cao làm dạ dày bị bào mòn. NaHCO3 (hay được gọi là thuốc muối) dùng để chế thuốc đau dạ dày vì nó làm giảm hàm lượng dung dịch HCl có trong dạ dày nhờ phản ứng:
$NaHC{O_3}\;{\text{ }} + \;\;{\text{ }}HCl\;{\text{ }}\; \to \;{\text{ }}\;NaCl\;{\text{ }} + {\text{ }}{H_2}O{\text{ }} + {\text{ }}C{O_2}$
Khí CO2 sinh ra thoát ra ngoài qua ống tiêu hoá hiện tượng ợ hơi.
Câu 4. Sodium sulfate ở điều kiện thường là chất rắn, màu trắng, được sử dụng nhiều trong các ngành công nghiệp.
a) Tìm hiểu qua internet, sách, báo, … hãy cho biết một số ứng dụng của sodium sulfate.
b) Hãy viết 3 phương trình hoá học tạo sodium sulfate.
Hướng dẫn giải
a) Một số ứng dụng của sodium sulfate: sản xuất thuốc nhuộm, bột giấy …
b) 3 phương trình hoá học tạo sodium sulfate:
2NaOH + H2SO4 → Na2SO4 + 2H2O
Na2O + H2SO4 → Na2SO4 + H2O
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O.
Câu 5: Vì sao mưa acid có thể làm hư hại các tượng bằng đá vôi để ngoài trời?
Hướng dẫn giải
Đá vôi có thành phần chủ yếu là calcium carbonate (CaCO3), tương đối cứng, không tan trong nước nhưng lại tan trong acid. Mưa axit là hiện tượng mưa có độ pH dưới 5,6, trong nước mưa có hòa tan một số phân tử acid có khả năng phản ứng với CaCO3 làm hư hại các bức tượng trên
E. BÀI TẬP TRẮC NGHIỆM
MỨC ĐỘ 1: BIẾT (7 câu biết)
Câu 1. Điền vào chỗ trống: “Muối là những hợp chất được tạp ra khi thay thế ion … trong … bằng ion kim loại hoặc ion ammonium ($NH_4^ + $).”
A. $O{H^ – }$base
B. $O{H^ – }$acid
C. ${H^ + }$, acid
D. ${H^ + }$, base
Câu 2. Muối không tan trong nước là:
A. CuSO4
B. CaSO4
C. Ca(NO3)2
D. BaSO4
Câu 3. Tính chất hóa học của muối là
A. Tác dụng với kim loại
B. Tác dụng với axit
C. Tác dụng với dung dịch bazơ
D. A, B, C đều đúng
Câu 4. Công thức của calcium carbonate là:
A. CaC2 B. CaCO3 C. CaSO4 D. Ca(HCO3)2
Câu 5. Hợp chất NaHSO4 có tên gọi là
A. Sodium sunfat.
B. Sodium sunfit.
C. Sodium hydrogensunfat.
D. Sodium sunfuric
Câu 6. Muối ăn có công thức hoá học là:
A. Na2SO4.
B. Na2CO3.
C. NaCl.
D. Na2S
Câu 7. Muối nào sau đây không tan?
A. KCl
B. KNO3
C. ZnCl2
D. ZnCO3
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 | 6 | 7 |
| C | D | D | B | C | C |
D |
MỨC ĐỘ 2 : HIỂU (5 câu )
Câu 1. Cho phương trình phản ứng:
$BaC{O_3}\; + {\text{ }}2HCl{\text{ }} \to {\text{ }}BaC{l_2}\; + {\text{ }}Y{\text{ }} + {\text{ }}{H_2}O$
Vậy Y là
A. CO
B. H2
C. Cl2
D. CO2
Câu 2. Cho dung dịch KOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là:
A. Có kết tủa trắng xanh.
B. Có khí thoát ra.
C. Có kết tủa đỏ nâu.
D. Kết tủa màu trắng.
Câu 3. Trộn 2 dung dịch nào sau đây sẽ không xuất hiện kết tủa ?
A. BaCl2, Na2SO4
B. Na2CO3, Ba(OH)2
C. BaCl2, AgNO3
D. NaCl, K2SO4
Câu 4. Hãy cho biết muối nào có thể điều chế bằng phản ứng của kim loại với dung dịch axit H2SO4 loãng?
A. ZnSO4
B. Na2SO3
C. CuSO4
D. MgSO3
Câu 5. Cho các phát biểu sau:
(1) Muối tác dụng với axit tạo thành muối mới và axit mới.
(2) Hai dung dịch muối tác dụng với nhau tạo thành hai muối mới.
(3) Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
(4) Phản ứng trung hòa không thuộc loại phản ứng trao đổi.
Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 |
| D | C | D | A |
D |
MỨC ĐỘ 3: VẬN DỤNG (GIẢI CHI TIẾT) 3 câu
Câu 1. Cho 35 gam CaCO3 vào dung dịch HCl dư, kết thúc phản ứng thu được bao nhiêu lít khí CO2 ở điều kiện chuẩn?
A. 7,84 lít
B. 6,72 lít
C. 8,68 lít
D. 5,90 lít
Hướng dẫn giải
${n_{CaC{O_3}}} = \frac{{35}}{{100}} = 0,35{\text{ (mol)}}$
PTHH: $CaC{{\text{O}}_3} + 2HCl \to CaC{l_2}{\text{ }} + {\text{ }}{H_2}{\text{O + C}}{{\text{O}}_{\text{2}}}$
Ta có: ${n_{C{O_2}}} = {n_{CaC{{\text{O}}_3}}} = 0,35{\text{ (mol)}}$
$ \Rightarrow {V_{C{O_2}}} = n.24,79 = 0,35.24,79 = 8,68{\text{ (L)}}$
Chọn C
 Câu 2. Quá trình tạo thành thạch nhũ trong các hang động đá vôi kéo dài hàng triệu năm. Quá trình này được giải thích bằng phương trình hóa học nào sau đây ?
Câu 2. Quá trình tạo thành thạch nhũ trong các hang động đá vôi kéo dài hàng triệu năm. Quá trình này được giải thích bằng phương trình hóa học nào sau đây ?
A. $Ca{\left( {HC{O_3}} \right)_2}\; \to {\text{ }}CaC{O_3}\; + {\text{ }}C{O_2}\; + {\text{ }}{H_2}O$
B. $Mg{\left( {HC{O_3}} \right)_2}\; \to {\text{ }}MgC{O_3}\; + {\text{ }}C{O_2}\; + {\text{ }}{H_2}O$
C. $CaC{O_3}\; + {\text{ }}C{O_2}\; + {\text{ }}{H_2}O{\text{ }} \to {\text{ }}Ca{\left( {HC{O_3}} \right)_2}$
D. $CaC{O_3}\; + {\text{ }}2HCl{\text{ }} \to {\text{ }}CaC{l_2} + {\text{ }}C{O_2}\; + {\text{ }}{H_2}O$
Hướng dẫn giải
Nước mưa khí quyển có chứa CO2 sẽ hòa tan rất mạnh các khoáng vật thuộc nhóm carbonate chuyển thành calcium hydrogencarbonate (Ca(HCO3)2)
$CaC{O_3}\; + {\text{ }}C{O_2}\; + {\text{ }}{H_2}O{\text{ }} \to {\text{ }}Ca{\left( {HC{O_3}} \right)_2}$
Ca(HCO3)2 chảy xuống theo các kẽ nứt bị phân hủy tạo thành CaCO3 → Thạch nhũ$Ca{\left( {HC{O_3}} \right)_2} \to CaC{O_3} \downarrow + C{O_2} + {H_2}O$
Chọn C
Câu 3. Muối được sử dụng làm bột nở cho bánh quy xốp là muối nào sau đây?
A. $N{a_2}C{O_3}$
B. $N{H_4}Cl$
C. $NaHC{O_3}$
D. $N{H_4}HC{O_3}$
Hướng dẫn giải
Muối được sử dụng làm bột nở cho bánh quy xốp là NH4HCO3 vì ở nhiệt độ cao muối này bị phân hủy hoàn toàn thành khí:
$N{H_4}HC{O_3}\;\;\xrightarrow{{{t^o}}}N{H_3}\; + {\text{ }}C{O_2}\; + {\text{ }}{H_2}O$
Chọn D