Chuyên đề KHTN 8 Chân trời sáng tạo bài 12 Oxide được soạn dưới dạng file word và PDF gồm 11 trang. Các bạn xem và tải về ở dưới.
BÀI 12 OXIDE
SÁCH GIÁO KHOA CHÂN TRỜI SÁNG TẠO
A/ TÓM TẮT LÝ THUYẾT
1/ KHÁI NIỆM OXIDE – PHƯƠNG TRÌNH HOÁ HỌC TẠO OXIDE
a/ Tìm hiểu khái niệm oxide
– Oxide là hợp chất gồm 2 nguyên tố trong đó có 1 nguyên tố là oxygen
VD: Fe3O4, SO2, CO2…
– Công thức hóa học chung của oxide là MxOy
b/ Tìm hiểu phản ứng tạo oxide
Các phản ứng hóa học tạo oxide
- Kim loại phản ứng với oxygen
kim loại + O2 $\xrightarrow{{t0}}$ oxide kim loại
ví dụ: 2Cu + O2 $\xrightarrow{{t0}}$ 2CuO
Phản ứng trên xảy ra với hầu hết các kim loại (trừ Au, Pt, Ag)
- Phi kim phản ứng với oxygen
Phi kim + O2 $\xrightarrow{{t0}}$ oxide phi kim
ví dụ: 4P + 5O2 $\xrightarrow{{t0}}$ 2 P2O5
Các phi kim thường gặp C, S, P…
2/ PHÂN LOẠI OXIDE
Tìm hiểu các loại oxide
Có 4 loại oxide:
Oxide acid là những oxide phản ứng được với dung dịch base tạo thành muối và nước.
Ví dụ: CO2, SO3, P2O5…
Oxide base là những oxide phản ứng được với dung dịch acid tạo thành muối và nước.
Ví dụ: MgO, FeO, K2O, CaO…
Oxide lưỡng tính (amphoteric oxide ) là những oxide vừa phản ứng được với dung dịch acid vừa phản ứng được với dung dịch base đều tạo thành muối và nước.
Ví dụ: Al2O3, ZnO…
Oxide trung tính (neutral oxide ) là những oxide không phản ứng được với dung dịch acid và dung dịch base
Ví dụ: CO, NO, N2O…
3/ TÍNH CHẤT HOÁ HỌC CỦA OXIDE
Tìm hiểu oxide acid phản ứng với dung dịch base
Oxide base phản ứng với dung dịch acid tạo thành muối và nước.
Ví dụ : Iron(III) oxide phản ứng với dung dịch hydrochloric acid theo phương trình hoá học:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Oxide acid phản ứng được với dung dịch base tạo thành muối và nước.
Ví dụ: SO2 + 2NaOH → Na2SO3 +H2O
B/ CÂU HỎI TRONG BÀI
| Mở đầu trang 56 KHTN 8: Một số oxide phổ biến tạo nên các khoáng chất như đá granite và thạch anh (oxide của silicon), gỉ sắt (oxide của sắt) và đá vôi (oxide của calcium và carbon). Đá ruby tự nhiên có dải màu từ hồng đậm đến đỏ sẫm do thành phần các oxide của alumium, chromium, … tạo nên. Oxide là gì? Có những loại oxide nào? Chúng có sẵn trong tự nhiên hay phải điều chế?
Trả lời: – Oxide là hợp chất gồm hai nguyên tố, trong đó có nguyên tố oxygen. – Có 4 loại oxide: + Oxide acid là oxide phản ứng được với dung dịch base tạo thành muối và nước. + Oxide base là oxide phản ứng được với dung dịch acid tạo thành muối và nước. + Oxide lưỡng tính là oxide vừa phản ứng được với dung dịch acid, vừa phản ứng với dung dịch base. + Oxide trung tính là các oxide không phản ứng với dung dịch acid, không phản ứng với dung dịch base. – Có những oxide có sẵn trong tự nhiên, có những oxide không có sẵn trong tự nhiên con người điều chế ra. Câu hỏi thảo luận 1 trang 56 KHTN 8: Thành phần của các chất ở Hình 12.1 có đặc điểm gì giống nhau?
Trả lời: Điểm giống nhau: Các hợp chất này đều gồm 2 nguyên tố, trong đó có 1 nguyên tố là oxygen. Luyện tập trang 56 KHTN 8: Chất nào là oxide trong các chất sau: ZnO; SiO2; KNO3; Fe2O3; Cl2O7; K2CO3? Trả lời: Chất là oxide: ZnO; SiO2; Fe2O3; Cl2O7. Câu hỏi thảo luận 2 trang 57 KHTN 8: Viết phương trình hoá học của phản ứng ở Ví dụ 2.
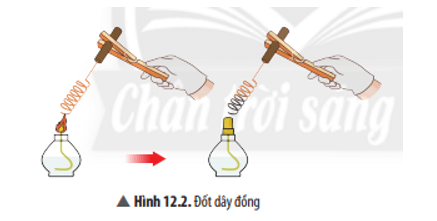
Trả lời: Phương trình hoá học: 2Cu + O2 $\xrightarrow{{t0}}$ 2CuO. Câu hỏi thảo luận 3 trang 57 KHTN 8: Viết phương trình hoá học của phản ứng xảy ra ở Ví dụ 4.
Trả lời: Phương trình hoá học: C + O2 $\xrightarrow{{t0}}$ CO2. Luyện tập trang 57 KHTN 8: Hãy viết các phương trình hoá học giữa khí oxygen và đơn chất tương ứng để tạo ra các oxide sau: Na2O, SO2, ZnO. Trả lời: 4Na + O2 → 2Na2O S + O2 $\xrightarrow{{t0}}$SO2 2Zn + O2 $\xrightarrow{{t0}}$2ZnO. Vận dụng trang 57 KHTN 8: Iron oxide trong công nghiệp có hai màu cơ bản là màu đen của iron(II) oxide và màu nâu đỏ của iron (III) oxide (hình trên). Qua nhiều giai đoạn xử lí công nghiệp, các iron oxide được ứng dụng làm bột màu trong xây dựng, công nghiệp gốm sứ, … Tìm hiểu trên internet và các tài liệu học tập, hãy cho biết thêm một số ứng dụng của các oxide này.
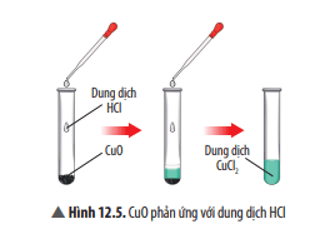
Trả lời: – Ứng dụng của iron(II) oxide: dùng điều chế Fe3O4, muối Fe(II) … Câu hỏi thảo luận 4 trang 58 KHTN 8: Thành phần của gỉ sét có chứa Fe2O3. Từ Ví dụ 5, hãy cho biết vì sao giấm ăn có thể làm sạch được gỉ sét trên bề mặt dụng cụ làm bằng sắt – thép. Trả lời: Giấm ăn có tính acid nên có thể phản ứng với gỉ sét tạo thành muối tan dễ rửa trôi. 6CH3COOH + Fe2O3 → 2(CH3COO)3Fe + 3H2O. Luyện tập trang 58 KHTN 8: Cho các oxide sau: Fe2O3; SiO2; K2O; SO2; NO2; BaO; CO2; CuO; CaO. Oxide nào trong các oxide trên là oxide base, oxide acid? Trả lời: Oxide base: Fe2O3; K2O; BaO; CuO; CaO. Oxide acid: SiO2; SO2; NO2; CO2. Câu hỏi thảo luận 5 trang 59 KHTN 8: Khi tiến hành các thí nghiệm với oxide của các kim loại beryllium, lead (chì), chromium (hoá trị III), ta thấy chúng đều vừa tan được trong dung dịch HCl, vừa tan được trong dung dịch NaOH. Theo em các oxide này được gọi là oxide gì. Trả lời: Các oxide này là oxide lưỡng tính do vừa tan được trong dung dịch HCl (acid), vừa tan được trong dung dịch NaOH (kiềm). Luyện tập trang 59 KHTN 8: Oxide (B) có khối lượng phân tử bằng 80 amu và chứa 60% oxygen theo khối lượng. Hãy xác định công thức hoá học của (B) và cho biết (B) thuộc loại oxide nào (oxide acid, oxide base, oxide lưỡng tính, oxide trung tính). Trả lời: Khối lượng oxygen có trong (B) là: $\frac{{80.60}}{{100}}$= 48(amu). Số nguyên tử oxygen trong (B) là: 48 : 16 = 3 (nguyên tử). Khối lượng nguyên tử còn lại trong (B) là: 80 – 48 = 32 (amu). Vậy (B) là SO3, đây là oxide acid. Câu hỏi thảo luận 6 trang 59 KHTN 8: Hãy nêu hiện tượng và viết phương trình hoá học của phản ứng xảy ra ở Thí nghiệm 1. Nếu thay dung dịch HCl bằng dung dịch H2SO4 thì có phản ứng hoá học xảy ra không? Giải thích.
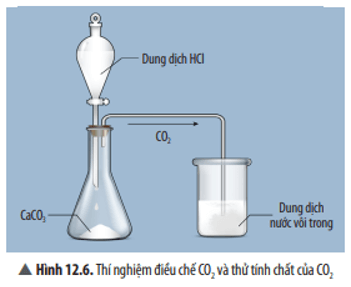
Trả lời: Hiện tượng: CuO tan dần, sau phản ứng thu được dung dịch có màu xanh. Phương trình hoá học: CuO + 2HCl → CuCl2 + H2O. Nếu thay HCl bằng H2SO4 thì phản ứng vẫn diễn ra, do CuO là oxide base nên tác dụng được với H2SO4 là acid. Luyện tập trang 60 KHTN 8: Hãy chọn oxide và acid tương ứng, viết phương trình hoá học tạo ra các muối sau: a) CaCl2. b) MgSO4. c)FeCl2. d) Fe2(SO4)3. Trả lời: a) CaO + 2HCl → CaCl2 + H2O b) MgO + H2SO4 → MgSO4 + H2O c) FeO + 2HCl → FeCl2 + H2O d) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O. Vận dụng trang 60 KHTN 8: Zinc chloride (ZnCl2) có nhiều ứng dụng như: dùng làm chất sát trùng, bảo quản gỗ, … a) Bằng tìm hiểu từ sách, báo và internet, hãy cho biết thêm một số ứng dụng của zinc chloride. b) Trong phòng thí nghiệm, zinc chloride có thể được tạo ra từ zinc oxide. Tính khối lượng zinc oxide cần phản ứng với dung dịch HCl dư để thu được 34 gam zinc chloride. Trả lời: a) Một số ứng dụng của zinc chloride: được dùng để mạ kẽm lên sắt, bôi vào khuôn trước khi đúc, đánh bóng thép, là hoá chất làm sạch bề mặt kim loại trước khi hàn. Ngoài ra, zinc chloride còn được dùng để làm chất tạo màu trắng trong sơn, chất xúc tác trong công nghiệp chế biến mủ cao su … b) Phương trình hoá học: ZnO + 2HCl → ZnCl2 + H2O Tỉ lệ: 1 : 2 : 1 : 1 Theo bài ra: nZnCl2= $\frac{{34}}{{136}}$= 0,25(mol) Theo phương trình hoá học: nZnO=nZnCl2=0,25(mol) Khối lượng ZnO cần dùng là: mZnO = 0,25 × 81 = 20,25 gam. Câu hỏi thảo luận 7 trang 60 KHTN 8: Quan sát Thí nghiệm 2 (Hình 12.6), hãy nêu hiện tượng và phản ứng hoá học của phản ứng xảy ra trong cốc thuỷ tinh.
Trả lời: Hiện tượng: Có kết tủa trắng xuất hiện. Phương trình hoá học: CO2 + Ca(OH)2 → CaCO3 + H2O. Luyện tập trang 61 KHTN 8: Có các oxide sau: SO3, P2O5, CO, MgO. Oxide nào phản ứng được với dung dịch KOH? Oxide nào phản ứng được với dung dịch HCl? Viết phương trình hoá học của phản ứng. Trả lời: – Các oxide phản ứng với KOH là: SO3, P2O5. Phương trình hoá học minh hoạ: SO3 + 2KOH → K2SO4 + H2O P2O5 + 6KOH → 2K3PO4 + 3H2O – Oxide phản ứng với dung dịch HCl là: MgO Phương trình hoá học minh hoạ: MgO + 2HCl → MgCl2 + H2O. Vận dụng trang 61 KHTN 8: Baking soda được sử dụng nhiều trong đời sống. Thành phần chính của baking soda có công thức hoá học là NaHCO3 (sodium hydrogencarbonate). Sodium hydrogencarbonate có thể được tạo ra bằng cách cho carbon dioxide tác dụng với sodium hydroxide.
a) Viết phương trình hoá học của phản ứng. b) Tính thể tích carbon dioxide (đkc) và khối lượng sodium hydroxide cần để tạo ra 420 gam sodium hydrogencarbonate. Trả lời: a) Phương trình hoá học của phản ứng: CO2 + NaOH → NaHCO3. b) Theo bài ra: nNaHCO3=$\frac{{420}}{{84}}$ =5(mol) Theo phương trình hoá học: nCO2=nNaOH=nNaHCO3 Thể tích carbon dioxide (đkc) cần dùng là: VCO2 =5×24,79=123,95(L) Khối lượng sodium hydroxide cần dùng là: mNaOH = 5 × 40 = 200 (gam). |
C. CÂU HỎI CUỐI BÀI HỌC
(KHÔNG CÓ)
D. TỰ LUẬN
Câu 1: Cho các oxide sau: FeO; SO3; Na2O; P2O5 CO2; CuO; BaO, N2O5. Oxide nào trong các oxide trên là oxide base, oxide acid?
Trả lời:
Oxide base: FeO; Na2O; BaO; CuO.
Oxide acid: SO3; P2O5 ; N2O5; CO2.
Câu 2: Có các muối: CaCO3, FeCl2, ZnSO4. Hãy cho biết muối nào có thể được điều chế bằng các phương pháp sau:
a) Oxide acid phản ứng với dung dịch base.
b) Oxide base phản ứng với dung dịch acid.
Viết phương trình hoá học của các phản ứng trên.
Trả lời:
Muối được điều chế bằng phương pháp:
a) Oxide acid phản ứng với dung dịch base là: CaCO3.
Ca(OH)2 + CO2 → CaCO3↓ + H2O.
b) Oxide base phản ứng với dung dịch acid: CuCl2, ZnSO4.
FeO + 2HCl → FeCl2 + H2O
ZnO + H2SO4 → ZnSO4 + H2O
Câu 3: Oxide (A) có khối lượng phân tử bằng 44 amu và chứa 72,7% oxygen theo khối lượng. Hãy xác định công thức hoá học của (B) và cho biết (B) thuộc loại oxide nào (oxide acid, oxide base, oxide lưỡng tính, oxide trung tính).
Trả lời:
Khối lượng oxygen có trong (B) là: $\frac{{44.72,7}}{{100}}$= 32 (amu).
Số nguyên tử oxygen trong (B) là: 32 : 16 = 2 (nguyên tử).
Khối lượng nguyên tử còn lại trong (B) là: 44 – 32 = 12 (amu).
Vậy (B) là CO2, đây là oxide acid.
Câu 4: Có các oxide sau: CO2, N2O5, NO, CuO. Oxide nào phản ứng được với dung dịch NaOH? Oxide nào phản ứng được với dung dịch HCl? Viết phương trình hoá học của phản ứng.
Trả lời:
– Các oxide phản ứng với NaOH là: CO2, N2O5.
Phương trình hoá học minh hoạ:
CO2 + 2NaOH → Na2CO3 + H2O
N2O5 + 2NaOH → 2NaNO3 + H2O
– Oxide phản ứng với dung dịch HCl là: CuO
Phương trình hoá học minh hoạ:
CuO + 2HCl → CuCl2 + H2O.
Câu 5: Na2CO3 (sodium carbonate) cũng giống như các loại muối khác – được ứng dụng rất nhiều trong công nghiệp. Đặc biệt trong lĩnh vực xử lý nước bể bơi.
a) Bằng tìm hiểu từ sách, báo và internet, hãy cho biết thêm một số ứng dụng của sodium carbonate.
b) Trong phòng thí nghiệm, Na2CO3 (sodium carbonate ) có thể được tạo ra từ CO2 (carbon đi oxide). Tính khối lượng carbon oxide cần phản ứng với dung dịch NaOH dư để thu được 21,2 gam sodium carbonate
Trả lời:
a) Một số ứng dụng của Na2CO3 (sodium carbonate) hay còn gọi là soda
+ Xử lý làm tăng pH cho hồ bơi
+ Công nghiệp luyện thủy tinh, Cilicat
+ Ứng dụng làm chất tẩy rửa (có nhiều trong thuốc tẩy)
+ Công nghiệp thực phẩm.
Một vài lưu ý khi dự trữ và sử dụng Soda: Để nơi khô ráo thoáng mát, không nên để cạnh hay chung với axit, tiếp xúc với bất kỳ hóa chất nào cũng nên sử dụng bảo hộ lao động cần thiết.
b) Phương trình hoá học: CO2 + 2NaOH → Na2CO3 + H2O
Tỉ lệ mol: 1 : 2 : 1 : 1
Theo bài ra: n Na2CO3 = $\frac{{21,2}}{{106}}$= 0,2(mol)
Theo phương trình hoá
học: nCO2= nNa2CO3 = 0,2(mol)
Khối lượng CO2 cần dùng là: m CO2= 0,2 × 44 = 8,8 gam.
E. BÀI TẬP TRẮC NGHIỆM
MỨC ĐỘ 1: BIẾT (7 câu biết)
Câu 1: Trong các công thức hóa học sau, đâu là công thức hóa học của oxide acid
A. FeO B. CuO C. N2O5 D. MgO
Câu 2: Trong các công thức sau, đâu là công thức đúng của oxide base
A. SO3 B. CO2 C. P2O5 D. CuO
Câu 3: Cho dãy các công thức hóa học sau, dãy có công thức của oxide là
A. CaO, C2H6O, ZnO, CO2 B. CaO, CO2, MgO, ZnO
C. C2H6O, SO2, H2O, Al2O3 D. Fe2O3, CH3OH, MgO, SO3
Câu 4: Tên gọi của CO2 là
A. carbon dioxide B. carbon oxide C. carbon (IV) oxide D. carbon pentaoxide
Câu 5: Tên gọi của CuO là
A. copper oxide B. copper (II) oxide C. copper trioxide D. copper pentaoxide
Câu 6: Oxide base có tính chất hóa học nào sau đây?
A. Oxide base tác dụng được với dung dịch base. B. Oxide base tác dụng được với dung dịch axit.
C. Oxide base tác dụng được với tất cả kim loại. D. Oxide base tác dụng được với muối.
Câu 7: Oxide acid có tính chất hóa học nào sau đây?
A. Oxide acid tác dụng được với dung dịch base. B. Oxide acid tác dụng được với dung dịch axit.
C. Oxide acid tác dụng được với tất cả kim loại. D. Oxide acid tác dụng được với muối.
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 | 6 | 7 |
| C | D | B | A | B | B |
A |
MỨC ĐỘ 2 : HIỂU (5 câu )
Câu 1: Chất tác dụng với dung dịch acid tạo ra muối và nước là
A. CO2. B. Na2O. C. SO2. D. P2O5.
Câu 2: Chất tác dụng với dung dịch base tạo ra muối và nước là
A. K2O. B. CuO. C. P2O5. D. CaO.
Câu 3: 0,05 mol FeO tác dụng vừa đủ với:
A. 0,02 mol HCl. B. 0,1 mol HCl. C. 0,05 mol HCl. D. 0,01 mol HCl.
Câu 4: Oxi hóa 16,8 gam Fe, thu được 21,6 g oxit sắt. Công thức hóa học của oxit sắt là
A. Fe2O3 B. FeO C. Fe3O4 D. Fe(OH)3
Câu 5: Một oxit của photpho có thành phần phần trăm của P bằng 43,66%. Biết phân tử khối của oxit bằng 142 đvC. Công thức hoá học của oxit là:
A. P2O3. B. P2O5. C. PO2. D. P2O4.
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 |
| B | C | B | B |
B |
MỨC ĐỘ 3: VẬN DỤNG (GIẢI CHI TIẾT) 3 câu
Câu 1: Vôi sống là một hợp chất có tên khoa học là calcium oxide với công thức CaO. Nó còn được gọi với cái tên canxia hay vôi nung, là một oxide của calcium với nhiều ứng dụng quan trọng. Vôi sống là một chất có dạng tinh thể rắn ở dạng bột hoặc vón cục màu trắng nhưng khi có chứa tạo chất, nó lại có màu vàng nhạt hay màu xám


Calcium carbonate là thành phần chính của đá vôi. Khi nung đá vôi xảy ra phản ứng hóa học sau:
calcium carbonate → calcium oxide + carbon đioxide. Biết rằng khi nung 280kg đá vôi tạo ra 140kg calcium oxide CaO (vôi sống) và 110kg khí carbon đioxide CO2.
Tỉ lệ phần trăm về khối lượng calcium carbonate chứa trong đá vôi là .
A. 73,7%
Hướng dẫn giải:
mCaCO3 = mCaO + mCO2
Khối lượng của CaCO3 đã phản ứng:
140 + 110 = 250 kg
Tỉ lệ phần trăm khối lượng CaCO3 chứa trong đá vôi:
% m CaCO3 = $\frac{{250}}{{280}}$.100%= 89,3%
B. 89,3%
C. 80,4%
D. 92.6%
Câu 2: Mercury (II) oxide, còn gọi là mercury monoxide có công thức phân tử là HgO và khối lượng phân tử là khoảng 217. Nó là chất rắn có màu cam tại điều kiện nhiệt độ và áp suất phòng. HgO có thể được điều chế bằng cách nung nóng mercury trong oxygen ở nhiệt độ khoảng 350 °C tạo thành mercury và cho oxygen thoát ra .

Nếu nung nóng 40,2g mercury trong oxy ở nhiệt độ khoảng 350 °C sẽ tạo thành số gam mercury (II) oxide và số lít oxygen thoát ra ở đktc lần lượt là .
A. 41,3 g; 2,958 l B. 42,3g; 3,958 l C. 43,3g; 4,958 l D.44,3g; 5,958 l
Hướng dẫn giải:
nHg=$\frac{m}{M}$=$\frac{{40,2}}{{201}}$ = 0,2 mol
2Hg + O2 $\xrightarrow{{t0}}$ 2HgO
0,2 mol 0,1 mol 0,2 mol
mHgO= n.M = 0,2.217 = 43,3 g
VO2= n. 24,79 =4,958 (l)
Câu 3: Baking soda ( NaHCO3)là một nguyên liệu phổ biến, chủ yếu được sử dụng trong các ngành công nghiệp hoá chất, dược phẩm và thực phẩm. Baking soda có tình kiếm và hút ẩm cao, thường ở dạng bột màu trắng với vị hơi mặn. Nhiều gia đình đã sử dụng nguyên liệu này để làm bánh, làm đẹp hoặc chất tẩy rửa. Để sản xuất NaHCO3 người ta cho NaOH phản ứng với Khí CO2

Hấp thụ hoàn toàn 4,958 lít CO2 (đktc) vào 200ml dung dịch NaOH 1M. Sau phản ứng thu được bao nhiêu gam muối nào sau đây
A. 16,8 g Na2CO3
B.16,8 g NaHCO3
C. 15,8 g NaHCO3
D. 15,8 g Na2CO3 và16,8 g NaHCO3
Hướng dẫn giải
nCO2= $\frac{V}{{24,79}}$=$\frac{{4.958}}{{24,79}}$= 0.2 (mol)
nNaOH= CM.V = 0,2.1=0.2(mol)
$\frac{{nNaOH}}{{nCO2}}$= 1 tạo muối NaHCO3
PTPƯ NaOH + CO2 → NaHCO3
Theo pt n NaHCO3 = nCO2 = 0,2 (mol)
m NaHCO3 = n.M = 0,2.84=16,8 g