Chuyên đề KHTN 8 Kết nối tri thức bài 7 Tốc độ phản ứng và chất xúc tác được soạn dưới dạng file word và PDF gồm 5 trang. Các bạn xem và tải về ở dưới.
BÀI 7: TỐC ĐỘ PHẢN ỨNG VÀ CHẤT XÚC TÁC
SGK KẾT NỐI TRI THỨC VỚI CUỘC SỐNG
A. TÓM TẮT LÝ THUYẾT
1. Tốc độ phản ứng
Tốc độ phản ứng là đại lượng đặc trưng cho sự nhanh, chậm của phản ứng hoá học.
Để xác định tốc độ phản ứng, ta có thể đo sự thay đổi của thể tích chất khí, khối lượng chất rắn hoặc nồng độ chất tan trong một đơn vị thời gian
2. Một số yếu tố ảnh hưởng đến tốc độ phản ứng
Tốc độ phản ứng tăng khi làm tăng các yếu tố: nồng độ, nhiệt độ, diện tích bề mặt tiếp xúc.
Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng sau phản ứng vẫn được giữ nguyên về khối lượng và tính chất hóa học
B. CÂU HỎI TRONG BÀI HỌC
Câu 1 [KNTT – SGK]: Một học sinh thực hiện thí nghiệm và ghi lại hiện tượng như sau:
Cho cùng một lượng hydrochloric acid vào hai ống nghiệm đựng cùng một lượng đá vôi ở dạng bột (ống nghiệm (1)) và dạng viên (ống nghiệm (2)). Quan sát hiện tượng thấy rằng ở ống nghiệm (1) bọt khí xuất hiện nhiều hơn và đá vôi tan hết trước.
Phản ứng giữa hydrochloric acid với đá vôi dạng bột xảy ra nhanh hơn hay chậm hơn so với phản ứng giữa hydrochloric acid với đá vôi dạng viên?
Hướng dẫn giải
Phản ứng giữa hydrochloric acid với đá vôi dạng bột xảy ra nhanh hơn so với phản ứng giữa hydrochloric acid với đá vôi dạng viên.
Câu 2 [KNTT – SGK]: Than cháy trong bình khí oxygen nhanh hơn cháy trong không khí. Yếu tố nào ảnh hưởng đến tốc độ của phản ứng đốt cháy than?
Hướng dẫn giải
Than cháy trong bình khí oxygen nhanh hơn cháy trong không khí. Yếu tố nồng độ đã ảnh hưởng đến phản ứng đốt cháy than.
Câu 3 [KNTT – SGK]: Khi “bảo quản thực phẩm trong tủ lạnh để giữ thực phẩm tươi lâu hơn” là đã tác động vào yếu tố gì để làm chậm tốc độ phản ứng?
Hướng dẫn giải
Khi “bảo quản thực phẩm trong tủ lạnh để giữ thực phẩm tươi lâu hơn” là đã tác động vào yếu tố nhiệt độ để làm chậm tốc độ phản ứng.
Câu 4 [KNTT – SGK]: Trong quá trình sản xuất sulfuric acid có giai đoạn tổng hợp sulfur trioxide (SO3). Phản ứng xảy ra như sau:
2SO2 + O2 → 2SO3.
Khi có mặt vanadium(V) oxide thì phản ứng xảy ra nhanh hơn.
a) Vanadium(V) oxide đóng vai trò gì trong phản ứng tổng hợp sulfur trioxide?
b) Sau phản ứng, khối lượng của vanadium(V) oxide có thay đổi không? Giải thích.
Hướng dẫn giải
a) Vanadium(V) oxide đóng vai trò là chất xúc tác trong phản ứng tổng hợp sulfur trioxide.
b) Sau phản ứng, khối lượng của vanadium(V) oxide không thay đổi. Do chất xúc tác là chất làm tăng tốc độ phản ứng nhưng sau phản ứng vẫn giữ nguyên về khối lượng và tính chất hoá học.
C. CÂU HỎI CUỐI BÀI HỌC
(KHÔNG CÓ)
D. CÂU TỰ LUẬN TƯƠNG TỰ
Câu 1:
(a)Thực phẩm bảo quản trong tủ lạnh sẽ giữ được lâu hơn
(b) Khi nấu một loại thực phẩm bằng nồi áp suất sẽ nhanh chín hơn
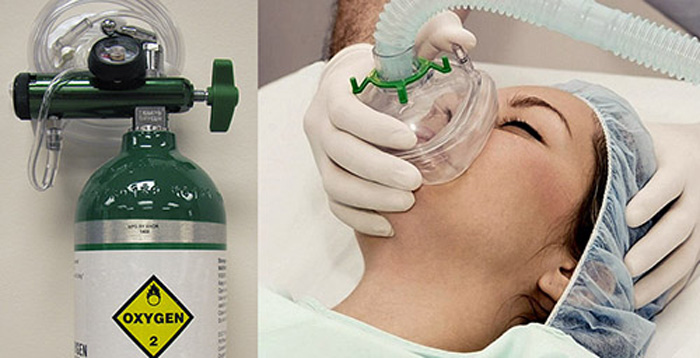
(c) Bệnh nhân sẽ dễ hô hấp hơn khi dùng oxygen từ bình chứa khí oxygen so với từ không khí


Những yếu tố nào ảnh hưởng đến tốc độ của các quá trình biến đổi trên.
Hướng dẫn giải
(a) Thực phẩm bảo quản trong tủ lạnh sẽ giữ được lâu hơn ⇒ Ảnh hưởng của nhiệt độ đến tốc độ phản ứng.
(b) Khi nấu một loại thực phẩm bằng nồi áp suất sẽ nhanh chín hơn ⇒ Ảnh hưởng của áp suất đến tốc độ phản ứng.
(c) Bệnh nhân sẽ dễ hô hấp hơn khi dùng oxygen từ bình chứa khí oxygen so với từ không khí ⇒ Ảnh hưởng của nồng độ đến tốc độ phản ứng.
Câu 2: Cho a g kim loại Zn dạng hạt vào lượng dư dung dịch HCl 2M, phương trình hóa học xảy ra như sau:
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Tốc độ khí H2 thoát ra như thế nào khi thay đổi các yếu tố dưới đây
a) Thay a g Zn hạt bằng a g bột Zn
b) Thay dung dịch HCl 2M bằng dung dịch HCl 1M
c) Thực hiện phản ứng ở nhiệt độ cao hơn bằng cách đun nóng nhẹ dung dịch HCl.
Hướng dẫn giải
a) Thay a g Zn hạt bằng a g bột Zn
⇒ Tăng diện tích tiếp xúc của chất phản ứng
⇒ Tăng tốc độ phản ứng
⇒ Khí H2 thoát ra nhanh hơn.
b) Thay dung dịch HCl 2M bằng dung dịch HCl 1M
⇒ Nồng độ chất tham gia giảm.
⇒ Tốc độ phản ứng giảm
⇒ Khí H2 thoát ra chậm hơn.
c) Thực hiện phản ứng ở nhiệt độ cao hơn bằng cách đun nóng nhẹ dung dịch HCl.
⇒ Tăng nhiệt độ của phản ứng
⇒ Tăng tốc độ phản ứng
⇒ Khí H2 thoát ra nhanh hơn.
Câu 3: Vào năm 1991, các nhà khoa học đã phát hiện ra xác ướp Otzi (Ốt – tờ – zi) – xác ướp tự nhiên được tìm thấy trong tuyết lạnh (có niên đại cách đây 5 300 năm) trên dãy núi Alps (An – pơ) gần biên giới giữa Áo và Italy.
Vì sao xác ướp này không cần đến hoá chất mà vẫn giữ nguyên vẹn hình thể?

Hướng dẫn giải
Tuyết lạnh có nhiệt độ rất thấp, nhiệt độ này gây ức chế sự phát triển của các vi sinh vật phân hủy xác ướp. Vì vậy quá trình phân huỷ xác cũng bị ức chế nên xác ướp không cần đến hoá chất mà vẫn giữ nguyên vẹn hình thể.
Câu 4: Tại sao trên các tàu đánh đánh cá, ngư dân thường phải chuẩn bị những thùng, hầm chứa đá lạnh để bảo quản cá?
Hướng dẫn giải
Do các hầm chứa này giữ cho cá đánh bắt được bảo quản ở nhiệt độ thấp, làm chậm quá trình cá bị oxi hóa và trở nên ôi thiu.
Câu 5: Cho hai cốc thủy tinh đựng nước lạnh và nước nóng, thả đồng thời vào cốc một viên vitamin c (dạng sủi) dự đoán xem cốc nào viên Vitamin C tan nhanh hơn?
Hướng dẫn giải
Cốc nước nóng thì vitamin C tan nhanh hơn do nước nóng có nhiệt độ cao hơn làm tốc độ phản ứng tăng.
E. BÀI TẬP TRẮC NGHIỆM
MỨC ĐỘ 1: BIẾT (7 câu biết)
Câu 1. Để đánh giá mức độ diễn ra nhanh hay chậm của phản ứng hóa học người ta dùng khái niệm nào sau đây?
A. Tốc độ phản ứng
B. Cân bằng hóa học
C. Phản ứng thuận nghịch
D. Phản ứng một chiều
Câu 2. Điền và hoàn thiện khái niệm về chất xúc tác sau.
“Chất xúc tác là chất làm …(1)… tốc độ phản ứng nhưng …(2)… trong quá trình phản ứng”
A. (1) thay đổi, (2) không bị tiêu hao. B. (1) tăng, (2) không bị tiêu hao.
C. (1) tăng, (2) không bị thay đổi. D. (1) thay, (2) bị tiêu hao không nhiều.
Câu 3. Để xác định tốc độ phản ứng, người ta dùng cách nào sau đây?
A. Đo sự thay đổi của thể tích chất khí, khối lượng chất rắn hoặc nồng độ chất tan trong một đơn vị thời gian.
B. Đo thời gian xảy ra phản ứng
C. Đo khối lượng các chất tham gia
D. Đo thể tích các chất tham gia
Câu 4. Phát biểu nào dưới đây là đúng khi nói về chất xúc tác?
A. Chất xúc tác là chất tham gia trực tiếp vào phản ứng hóa học, làm tăng tốc độ phản ứng
B. Chất xúc tác là chất tham gia gián tiếp vào phản ứng hóa học, làm tăng tốc độ phản ứng
C. Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng sau phản ứng vẫn được giữ nguyên về khối lượng và tính chất hóa học D. Chất xúc tác là chất làm tăng tốc độ phản ứng, có khối lượng thay đổi trong quá trình phản ứng
Câu 5. Tốc độ phản ứng là đại lương đặc trưng cho
A. thời gian phản ứng B. khối lượng chất đã tham gia phản ứng
C. sự nhanh chậm của phản ứng hóa học D. thể tích chất đã tham gia phản ứng
Câu 6. Chất làm tăng tốc độ phản ứng, nhưng sau phản ứng vẫn có khối lượng không đổi là
A. Chất xúc tác B. Chất tham gia
C. Chất sản phẩm D. Chất trung gian
Câu 7. Chất làm tăng tốc độ phản ứng hóa học nhưng vẫn không bị biến đổi về mặt hóa học được gọi là
A. Chất xúc tác B. Chất tham gia
C. Chất sản phẩm D. Chất trung gian
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 | 6 | 7 |
| A | B | A | A | C | A |
A |
MỨC ĐỘ 2 : HIỂU (5 câu )
Câu 1. Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây?
A. Xúc tác B. Nhiệt độ C. Áp suất D. Thời gian
Câu 2. Khi tăng nhiệt độ thì tốc độ của phản ứng sẽ
A. biến đổi ít B. tăng C. giảm D. không đổi
Câu 3. Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn) để ủ rượu?
A. Nhiệt độ B. Xúc tác C. Áp suất D. Nồng độ
Câu 4. Sự thay đổi nào dưới đây không làm tăng tốc độ phản ứng xảy ra giữa dây magnesium và dung dịch hydrochloric acid?
A. Cuộn dải magnesium thành một quả bóng nhỏ.
B. Tăng nồng độ của hydrochloric acid.
C. Nghiền mảnh magnesium thành bột.
D. Tăng nhiệt độ của hydrochloric acid.
Câu 5. Cho các yếu tố sau: nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác. Trong những yếu tố trên, có bao nhiêu yếu tố ảnh hưởng đến tốc độ phản ứng?
A. 3 B. 4 C. 2 D. 5
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 |
| D | B | B | A |
D |
MỨC ĐỘ 3: VẬN DỤNG (GIẢI CHI TIẾT) 3 câu
Câu 1. Các quả pháo hoa khi được bắn lên sẽ bốc cháy nhanh và nổ ra thành những chùm ánh sáng đẹp mắt. Vì sao khi sản xuất pháo hoa người ta thường sử dụng các nguyên liệu ở dạng bột?

A. Nguyên liệu ở dạng bột có khối lượng nhẹ hơn
B. Nguyên liệu ở dạng bột có diện tích tiếp xúc lớn hơn C. Nguyên liệu dạng bột có giá thành rẻ hơn
D. Nguyên liệu dạng bột có chất xúc tác
Câu 2. Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố nào đã được sử dụng để làm tăng tốc độ phản ứng ?
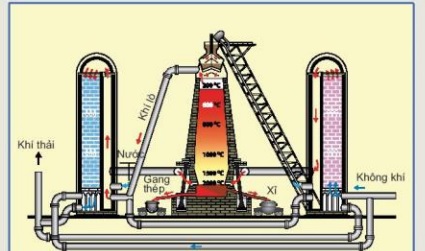
A. Nhiệt độ, áp suất. B. diện tích tiếp xúc.
C. Nồng độ. D. xúc tác.
Câu 3. Viên than tổ ong(như hình bên) thường được sản xuất với nhiều lỗ nhỏ. Theo em, các lỗ nhỏ đó được tạo ra với mục đích chính nào sau đây?

A. Làm giảm trọng lượng viên than
B. Giúp viên than trông đẹp mắt hơn
C. Làm tăng diện tích của than với oxygen khi cháy
D. Tăng nhiệt độ khi than cháy
ĐÁP ÁN
|
1 |
2 | 3 |
| B | A |
C |