Chuyên đề KHTN 8 Cánh diều bài 8 Acid được soạn dưới dạng file word và PDF gồm 9 trang. Các bạn xem và tải về ở dưới.
BÀI 8: ACID
SGK CÁNH DIỀU
A. TÓM TẮT LÝ THUYẾT
I. KHÁI NIỆM ACID
– Acid là những hợp chất trong phân tử có nguyên tử hydrogen liên kết với gốc acid. Khi tan trong nước acid tạo ra ion H+.
– Acid tạo ra ion H+ theo sơ đồ sau: Acid $ \to $ ion H+ + ion âm gốc acid
Ví dụ:
HCl $ \to $${H^ + }{_{}^{\;\;\;\;}}$ + $\;\;\;\;\;\;\;\;\;\;\;\;\;C{l^ – }$
Hydrochloric acid Ion hydrogen Ion chloride
H2SO4$ \to $2${H^ + }{_{}^{\;\;\;\;}}$ + $S{O_4}^{2 – }$
Sulfuric acid Ion hydrogen Ion Sulfate
II. TÍNH CHẤT HÓA HỌC:
1. Làm đổi màu chất chỉ thị màu:
Dung dịch acid làm quỳ tím chuyển sang màu đỏ.
2. Tác dụng với kim loại:
Dung dịch acid tác dụng được với nhiều kim loại tạo ra muối và khí hydrogen.
Acid + Kim loại $ \to $ Muối + hydrogen.
Ví dụ:
Fe + 2HCl $ \to $ FeCl2 + H2 $ \uparrow $
Iron Hydrochloric acid Iron (II) chloride Hydrogen
Zn + H2SO4 (loãng) $ \to $ ZnSO4 + H2 $ \uparrow $
Zinc Sulfuric acid Zinc sulfate Hydrogen
III. ỨNG DỤNG CỦA MỘT SỐ ACID:
1. Hydrochcloric acid (HCl)
– Hydrochcloric acid có trong dạ dày của người và động vật giúp tiêu hóa thức ăn.
– Hydrochcloric acid được sử dụng nhiều trong công nghiệp.
– Một số ứng dụng quan trọng của hydrochcloric acid: Sản xuất tẩy rửa kim loại, sản xuất chất dẻo, điều chế glucose, sản xuất dược phẩm.
2. Sulfuric acid (H2SO4)
– Sulfuric acid là một hóa chất quan trọng được sử dụng nhiều trong công nghiệp.
– Một số ứng dụng quan trọng của sulfuric acid: sản xuất giấy, acquy, chất dẻo, sơn, phân bón.
3. Acetic acid (CH3COOH)
– Acetic acid là một acid hữu cơ có trong giấm ăn với nồng dộ khoảng 4%.
– Một số ứng dụng của acetic acid: sản xuất tơ nhân tạo, thuốc diệt côn trùng, chất dẻo, phẩm nhuộm, dược phẩm.
B. CÂU HỎI TRONG BÀI HỌC
Câu 1. [CD – SGK trang 47]: Các loại quả trong hình dưới đây có đặc điểm gì giống nhau? Theo em, vì sao chúng lại có đặc điểm giống nhau đó?

Hướng dẫn giải
Các loại quả trong hình có đặc điểm giống nhau là đều có vị chua. Sở dĩ các loại quả này có vị chua do thành phần của nó có chứa acid.
Câu 2. [CD – SGK trang 47]: Nêu đặc điểm chung về thành phần phân tử của các acid.
Hướng dẫn giải
Thành phần phân tử của các acid đều có chứa nguyên tử hydrogen.
Câu 3. [CD – SGK trang 47]: Viết sơ đồ tạo thành ion H+ từ nitric acid (HNO3).
Hướng dẫn giải
Sơ đồ tạo thành ion H+ nitric acid là:
$HN{O_3} \to {H^ + } + N{O_3}^ – $
Câu 4. [CD – SGK trang 48]: Khi thảo luận về tác dụng của dung dịch acid với quỳ tím có hai ý kiến sau:
a. Nước làm quỳ tím đổi màu.
b. Dung dịch acid làm quỳ tím đổi màu.
Để xuất một thí nghiệm để xác định ý kiến đúng trong hai ý kiến trên.
Hướng dẫn giải:
Đề xuất thí nghiệm:
Chuẩn bị:
– Dụng cụ: Ống nghiệm, ống hút nhỏ giọt, giá đỡ thí nghiệm.
– Hóa chất: Các dung dịch acid: HCl, HNO3, H2SO4; giấy quỳ tím; nước cất.
Tiến hành:
– Lấy 4 ống nghiệm, đánh số từ 1 đến 4.
– Cho vào ống nghiệm 1 khoảng 2 mL dung dịch HCl, ống nghiệm 2 khoảng 2 mL dung dịch HNO3, ống nghiệm 3 khoảng 2 mL dung dịch H2SO4, ống nghiệm 4 khoảng 2 mL nước cất.
– Sau đó cho lần lượt vào mỗi ống nghiệm 1 mẩu quỳ tím. Quan sát sự đổi màu của quỳ tím và rút ra nhận xét.
Câu 5. [CD – SGK trang 48]: Lần lượt nhỏ lên ba mẩu giấy quỳ tím mỗi dung dịch sau:
a. Nước đường.
b. Nước chanh.
c. Nước muối (dung dịch NaCl).
Trường hợp nào quỳ tím sẽ chuyển sang màu đỏ?
Hướng dẫn giải
Trường hợp b) nước chanh sẽ làm quỳ tím chuyển sang màu đỏ do nước chanh chứa nhiều acid citric.
Câu 6. [CD – SGK trang 49]: Người ta thường tránh muối dưa, cà trong các dụng cụ làm bằng nhôm. Cho biết lí do của việc làm trên.
Hướng dẫn giải
Các loại dưa, cà muối chua có chứa nhiều acid. Tránh muối dưa, cà trong các dụng cụ bằng nhôm do acid có thể tác dụng với kim loại nhôm giải phóng ion kim loại gây độc hại cho cơ thể.
Câu 7. [CD – SGK trang 49]: Viết phương trình hóa học xảy ra trong các trường hợp sau:
a. Dung dịch H2SO4 loãng tác dụng với Zn.
b. Dung dịch HCl loãng tác dụng với Mg.
Hướng dẫn giải
a. $Zn\;\; + {\text{ }}{H_2}S{O_{4(loãng)}} \to \;\;\;ZnS{O_4}\;\;\;\; + \;\;{H_2} \uparrow $
b. $Mg\; + {\text{ }}HCl\; \to MgS{O_4}\;\;\; + \;\;\;{H_2} \uparrow $
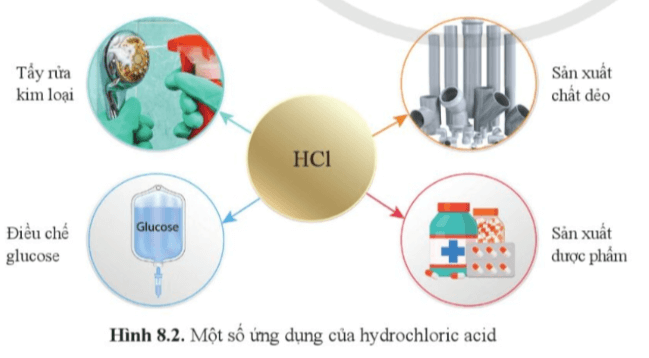
Câu 8. [CD – SGK trang 49]: Dựa vào hình 8.2, nêu một số ứng dụng của hydrochloric acid.
Hướng dẫn giải
Một số ứng dụng của hydrochloric acid:
– Tẩy rửa kim loại;
– Sản xuất chất dẻo;
– Điều chế glucose;
– Sản xuất dược phẩm ….
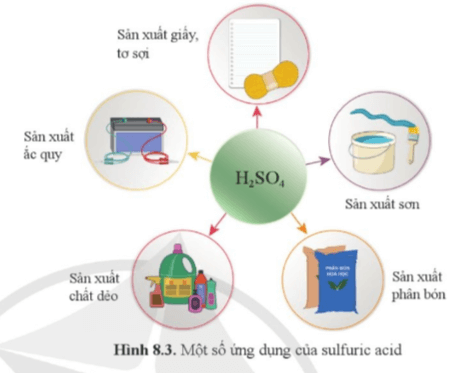
Câu 9. [CD – SGK trang 50]: Dựa vào hình 8.3, nêu một số ứng dụng của sulfuric acid.
Hướng dẫn giải
Một số ứng dụng của sulfuric acid:
– Sản xuất giấy, tơ sợi;
– Sản xuất ắc quy;
– Sản xuất sơn;
– Sản xuất chất dẻo;
– Sản xuất phân bón…
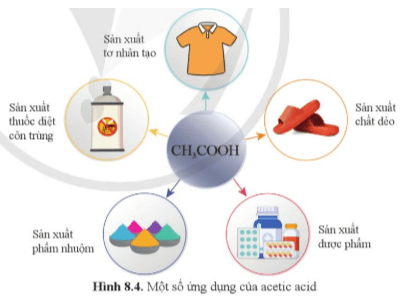
Câu 10. [CD – SGK trang 50]: Dựa vào hình 8.4, nêu một số ứng dụng của acetic acid.
Hướng dẫn giải
Một số ứng dụng của acetic acid:
– Sản xuất tơ nhân tạo;
– Sản xuất chất dẻo;
– Sản xuất dược phẩm;
– Sản xuất phẩm nhuộm;
– Sản xuất thuốc diệt côn trùng …
Câu 11. [CD – SGK trang 50]: Nêu tên một số món ăn có sử dụng giấm ăn trong quá trình chế biến.
Hướng dẫn giải
Một số món ăn sử dụng giấm trong quá trình chế biến: nộm; bò nhúng giấm; canh chua; …
C. CÂU HỎI CUỐI BÀI HỌC
(KHÔNG CÓ)
D. TỰ LUẬN
Câu 1: Viết sơ đồ tạo thành ion H+ từ Sulfurous acid (H2SO3), Phosphoric acid (H3PO4).
Hướng dẫn giải
Sơ đồ tạo thành ion H+ nitric acid là:
${H_2}S{O_{3\;\;}} \to \;\;\;\;2{H^ + }\;\;\;\;\; + \;\;\;S{O_3}^{2 – }$
Sơ đồ tạo thành ion H+ nitric acid là:
${H_3}P{O_{4\;\;}} \to \;\;\;\;3{H^ + }\;\;\;\;\; + \;\;\;P{O_4}^{3{ – ^{}}}$
Câu 2: Cho các kim loại sau: Zn, Fe, Cu, Al, Ag, Mg tác dụng lần lượt với dung dịch hydrochloric acid (HCl) và sulfuric acid (H2SO4 loãng). Viết phương trình phản ứng (nếu có)
Hướng dẫn giải
– Kim loại Cu, Ag không tác dụng với dung dịch HCl và H2SO4 loãng.
– PTHH:
$Zn\;\; + \;\;2HCl\;\; \to \;\;ZnC{l_{2\;}}\; + \;\;{H_2} \uparrow $
$Fe\;\;\; + \;\;2HCl\;\; \to \;\;FeC{l_2}\;\; + \;\;{H_2} \uparrow $
$Mg\;\; + \;\;2HCl\;\; \to \;\;ZnC{l_{2\;}}\; + \;\;{H_2} \uparrow $
$2Al\;\; + \;\;6HCl\;\; \to \;\;2AlC{l_{3\;}}\; + \;\;3{H_2} \uparrow $
$Zn\;\;\;\; + \;\;{H_2}S{O_4}\;\; \to \;\;ZnS{O_{4\;}}\; + \;\;{H_2} \uparrow $
$Fe\;\;\;\; + \;\;{H_2}S{O_4}\;\; \to \;\;FeS{O_{4\;}}\;\; + \;\;\;{H_2} \uparrow $
$Mg\;\; + \;\;{H_2}S{O_4}\;\; \to \;\;MgS{O_4}\;\; + \;\;{H_2} \uparrow $
$2Al\;\; + \;\;3{H_2}S{O_{4\;}}\; \to \;\;A{l_2}{\left( {S{O_4}} \right)_3}\;\; + \;\;3{H_2} \uparrow $
Câu 3: Cho 10 gam hỗn hợp bột hai kim loại Copper và Iron. Hãy giới thiệu phương pháp xác định thành phần phần trăm (theo khối lượng) của mỗi kim loại trong hỗn hợp theo:
a. Phương pháp hóa học. Viết các PTHH xảy ra.
b. Phương pháp vật lí.
(Biết rằng đồng không tác dụng với dung dịch axit HCl, H2SO4 loãng).
Hướng dẫn giải
a. Phương pháp hóa học: Ngâm hỗn hợp bột Fe và Cu vào dung dịch axit HCl hoặc H2SO4 loãng, lấy dư cho đến khi khí ngừng thoát ra (Fe đã phản ứng hết), lọc lấy chất rắn còn lại, rửa nhiều lần trên giấy lọc, làm khô và cân. Chất rắn đó là Cu.
Giả sử có m gam Cu. Thành phần phần trăm theo khối lượng của đồng là:
$\% {m_{Cu}} = \frac{{{m_{Cu}}}}{{10}}.100 \Rightarrow \% {m_{Fe}} = 100\% – \,\% {m_{Cu}}$
b. Phương pháp vật lí: Dùng thanh nam châm, sau khi đã bọc đầu nam châm bằng mảnh nilon mỏng và nhỏ. Chà nhiều lần vào hỗn hợp để lấy riêng Fe ra (Vì sắt bị nam châm hút còn đồng không bị nam châm hút), rồi đem cân.
$\% {m_{Fe}} = \frac{{{m_{Fe}}}}{{10}}.100 \Rightarrow \% {m_{Cu}} = 100\% – \,\% {m_{Fe}}$
Câu 4: Cho 5,4 gam kim loại M (hóa trị III) tác dụng vừa hết với HCl thu được 6,72 khí H2 (đktc). Xác định kim loại M.
Hướng dẫn giải
Số mol khí H2 là: ${n_{{H_2}}} = \frac{{{V_{{H_2}}}}}{{24,79}} = \frac{{6,72}}{{24,79}} = 0,3\,(mol)$
PTHH: 2M + 6HCl $ \to $ 2MCl3 + 3H2
Theo PTPỨ ta có: nM = $\frac{{0,3.2}}{3}$ = 0,2 (mol)
⇒${M_A} = \frac{{{m_A}}}{{{n_A}}} = \frac{{5,4}}{{0,2}} = 27\,(g/mol)$
Kim loại A là Al.
Câu 5: Cần phải làm gì nếu bản thân hoặc người thân xung quanh mình không may bị bỏng axit?
| Hướng dẫn giải
Khi không may bị bỏng axit, ta cần: – Loại bỏ nguyên nhân gây bỏng bằng cách: + Rửa sạch hóa chất ra khỏi bề mặt da dưới vòi nước lạnh trong 15 phút trở lên. + Nếu hóa chất gây bỏng là chất dạng bột như vôi, hãy chải sạch nó khỏi da trước khi rửa. – Chú ý không cởi quần áo người bị bỏng vì như thế rất dễ gây lột da. Các vùng hoá chất hoặc axit chỉ mới bám vào quần áo thì cần nhẹ nhàng cắt bỏ. – Khi tiếp xúc nhớ không tiếp xúc bằng tay không. – Che phủ vùng bị bỏng bằng băng gạc khô, vô trùng hoặc quần áo sạch. – Đến bệnh viện hoặc gọi cấp cứu ngay |
 |
E. BÀI TẬP TRẮC NGHIỆM
MỨC ĐỘ 1: BIẾT (7 câu biết)
Câu 1. Điền vào chỗ trống: “Acid là những … trong phân tử có nguyên tử … liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion …”
A. Đơn chất, hydrogen, $O{H^ – }$ . B. Đơn chất, hydroxide, $O{H^ – }$.
C. Hợp chất, hydroxide, ${H^ + }.$ D. Hợp chất, hydrogen, ${H^ + }.$
Câu 2. Chất nào sau đây là axit?
A. CaO. B. H2SO4. C. NaOH. D. KHCO3.
Câu 3. Chất nào sau đây không phải là axit?
A. NaCl. B. HNO3. C. HCl. D. H2SO4.
Câu 4. Dung dịch chất nào sau đây làm quỳ tím hóa đỏ?
A. Ca(OH)2. B. HCl. C. NaOH. D. Na2SO4.
Câu 5. Khi cho mẩu quỳ tím vào dung dịch axit carbonic acid thì quỳ tím
A. không đổi màu. B. chuyển vàng. C. chuyển xanh. D. chuyển đỏ.
Câu 6. Axit H2SO4 loãng tác dụng với Fe tạo thành sản phẩm:
A. Fe2(SO4)3 và H2. B. FeSO4 và H2.
C. FeSO4 và SO2. D. Fe2(SO4)3 và SO2.
Câu 7. Kim loại nào sau đây không tan được trong dung dịch HCl?
A. Al. B. Ag. C. Zn. D. Mg.
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 | 6 | 7 |
| D | B | A | B | D | B |
B |
MỨC ĐỘ 2: HIỂU (5 câu)
Câu 8. Dãy các chất thuộc loại axit là
A. HCl, H2SO4, Na2S. B. Na2SO4, H2SO4, HNO3.
C. H2SO4, HNO3, Na2S. D. HCl, H2SO4, HNO3.
Câu 9. Dãy gồm các kim loại đều tác dụng được với dung dịch HCl là
A. Cu, Fe, Al. B. Fe, Mg, Al. C. Cu, Pb, Ag. D. Fe, Au, Cr.
Câu 10. Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng là
A. Fe, Cu, Mg. B. Zn, Fe, Cu. C. Zn, Fe, Al. D. Fe, Zn, Ag.
Câu 11. Dung dịch Hydrochloric acid tác dụng với Ion tạo thành:
A. Iron (II) chloride và khí hydrogen. B. Iron (III) chloride và khí hydrogen.
C. Iron (II) sunfide và khí hydrogen. D. Iron (II) chloride và nước.
Câu 12. Axit nào tác dụng được với Mg tạo ra khí H2?
A. H2SO4 đặc, HCl. B. HNO3 loãng, H2SO4 loãng.
C. HNO3 đặc, H2SO4 đặc. D. HCl, H2SO4 loãng.
ĐÁP ÁN
|
8 |
9 | 10 | 11 | 12 |
| D | B | C | A |
D |
MỨC ĐỘ 3: VẬN DỤNG (GIẢI CHI TIẾT) 3 câu
Câu 13. Cho 5,6 g sắt tác dụng với hydrochloric acid dư, sau phản ứng thể tích khí H2 thu được (ở đktc):
A.1,24 lit. B. 2,479 lit. C. 12,4 lit. D. 24,79 lit.
Hướng dẫn giải
Số mol khí H2 là: ${n_{Fe}} = \frac{{{m_{Fe}}}}{{{M_{Fe}}}} = \frac{{5,6}}{{56}} = 0,1\,(mol)$
PTHH: Fe + HCl $ \to $ FeCl2 + H2
0,1 mol 0,1 mol
Theo PTPỨ ta có: ${n_{Fe}} = {n_{{H_2}}} = 0,1\,(mol)$
⇒${V_{_{{H_2}}}} = {n_{_{{H_2}}}}.24,79 = 01.24,79 = 2,479\,(lit)$
Chọn B
Câu 14. Hòa tan hết 16,8 gam kim loại A hóa trị II trong dung dịch acid HCl, sau phản ứng thu được 7,437 lít khí H2 ở đktc. Kim loại A là
A. Fe. B. Mg. C. Cu. D. Zn.
Hướng dẫn giải
Số mol khí H2 là: ${n_{{H_2}}} = \frac{{{V_{{H_2}}}}}{{24,79}} = \frac{{6,72}}{{24,79}} = 0,3\,(mol)$
PTHH: A + HCl $ \to $ ACl2 + H2
0,3 mol 0,3 mol
Theo PTPỨ ta có: nA = 0,3 mol
⇒${M_A} = \frac{{{m_A}}}{{{n_A}}} = \frac{{16,8}}{{0,3}} = 56\,(g/mol)$
Kim loại A là Fe.
Chọn A
Câu 15. Loại bỏ chất cặn trong ấm đun nước bằng cách dùng
A. Muối. B. giấm ăn hoặc chanh. C. Sulfuric acid. D. permanganate.
| Hướng dẫn giải
Chanh và giấm đều là những chất có chứa axit nên có tác dụng làm sạch vết bẩn rất hiệu quả. Hơn nữa đây là hai nguyên liệu thường có sẵn tại nhà nên bạn có thể tận dụng, vừa đơn giản vừa tiết kiệm chi phí. |
 |
Chọn B