Chuyên đề KHTN 8 Kết nối tri thức bài 8 Acid được soạn dưới dạng file word và PDF gồm 3 trang. Các bạn xem và tải về ở dưới.
BÀI 8: ACID
A. TÓM TẮT LÝ THUYẾT
I – Khái niệm acid
Acid là những hợp chất trong phân tử có nguyên tử hydrogen liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion H+
II – Tính chất hóa học của acid
1. Acid thường tan được trong nước, dung dịch acid làm đổi màu giấy quỳ tím từ tím sang đỏ
2. Dung dịch acid phản ứng với một số kim loại: magnesium, sắt, kẽm,… tạo thành muối và giải phóng khí hydrogen
$Mg + H_2^{}SO_4^{} \to MgSO_4^{} + H_2^{} \uparrow $
III – Một số acid thông dụng
1. Sulfuric acid
– Sunlfuric acid ($H_2^{}SO_4^{}$) là chất lỏng không màu, không bay hơi, sánh như dầu ăn, nặng gần gấp 2 lần nước, tan vô hạn trong nước và tỏa rất nhiều nhiệt
– Sunlfuric acid là hóa chất được sử dụng nhiều trong các nhành công nghiệp
– Lưu ý: Tuyệt đối không tự ý pha loãng dung dịch Sunlfuric acid đặc
2. Hydrochlric acid
– Hydrochlric acid ($HCl$) là chất lỏng không màu
– Hydrochlric acid được sử dụng nhiều trong các ngành công nghiệp
B. CÂU HỎI TRONG BÀI HỌC
Câu 1. Hãy cho biết gốc acid trong cá acid sau: $H_2^{}SO_4^{};HCl;HNO_3^{}$?
Trả lời:
| Acid | Gốc acid |
| $H_2^{}SO_4^{}$ | $SO_4^{}$ |
| $HCl$ | $Cl$ |
| $HNO_3^{}$ | $NO_3^{}$ |
Câu 2. Cho dung dịch HCl tác dụng với kim loại Mg. Viết phương trình hóa học của phản ứng xảy ra?
Trả lời: $Mg + 2HCl \to MgCl_2^{} + H_2^{} \uparrow $
Câu 3. Sử dụng hình 8.1 để trình bày về các ứng dụng của sunfuric acid?
Trả lời: Các ứng dụng của sunfuric acid là:
1. Sản xuất phẩm nhuộm
2. Sản xuất giấy, tơ sợi
3. Sản xuất sơn
4. Sản xuất chất dẻo
5. Sản xuất chất tẩy rửa
6. Sản xuất phân bón
Câu 4. Sử dụng hình ảnh 8.2 để trình bày về một số ứng dụng của hydrochloric acid?
Trả lời: Một số ứng dụng của hydrochloric acid là:
1. Tẩy gỉ thép
2. Tổng hợp chất hữu cơ
3. Xử lí pH nước bể bơi
C. CÂU HỎI CUỐI BÀI HỌC
Không có
D. TỰ LUẬN TƯƠNG TỰ
Câu 1. Hãy cho biết gốc acid trong các acid sau: $HBr;H_2^{}SO_3^{};H_3^{}PO_4^{}$
Câu 2. Cho dung dịch Sunlfuric acid và Hydrochlric acid lần lượt tác dụng với kim loại sắt. Hãy viết các phương trình hóa học của phản ứng xảy ra.
Câu 3. Hydrochlric acid có trong dạ dày đóng vai trò quan trọng trong quá trình tiêu hóa. Em hãy trình bày những vai trò của Hydrochlric acid trong quá trình tiêu hóa ở dạ dày ?
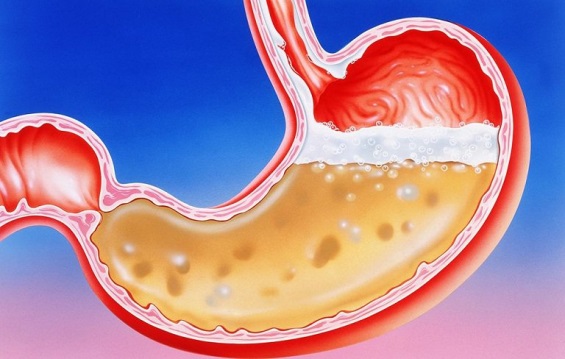
Câu 4. Trong dân gian người ta thường loại bỏ chất cặn trong các dụng cụ đun nước bằng cách dùng giấm ăn hay nước quả chanh. Em hãy tìm hiểu và giải thích vì sao người ta lại làm như vậy?

Câu 5. Hiện nay, trong các chất tẩy rửa thường có thành phần acid mạnh. Em hãy nêu các biện pháp để sử dụng an toàn các chất tẩy rửa này?

E. BÀI TẬP TRẮC NGHIỆM
MỨC ĐỘ 1: BIẾT (7 câu)
Câu 1. Phân tử acid gồm có:
A. Một hay nhiều nguyên tử phi kim liên kết với gốc acid.
B. Một hay nhiều nguyên tử hydrogen liên kết với gốc acid.
C. Một hay nhiều nguyên tử kim loại liên kết với nhóm hiđroxit (OH).
D. Một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc acid.
A. $HCl$. B. $H_2^{}SO_4^{}$. C. $HNO_3^{}$. D. $H_3^{}PO_4^{}$.
Câu 2. Chất nào sau đây là acid?
A. NaOH. B. CaO. C. KHCO3. D. H2SO4.
Câu 3. Chất nào sau đây không phải là acid?
A. NaCl. B. HNO3. C. HCl. D. H2SO4.
Câu 4. Trong số những chất có công thức hoá học dưới đây, chất nào quỳ tím đổi từ màu tím sang màu đỏ?
A. HNO3. B. NaOH. C. Ca(OH)2. D. NaCl.
Câu 5. Đâu không phải là tính chất của dung dịch sunfuric acid?
A. không màu B. tan rất ít trong nước.
C. không bay hơi D. làm quỳ tím chuyển từ tím sang đỏ
Câu 6. Cho kim loại magnesium tác dụng với dung dịch sunfuric acid loãng. Phương trình hóa học nào minh họa cho phản ứng hóa học trên?
A. $Mg + 2HCl \to MgCl_2^{} + H_2^{} \uparrow $
B. $Mg + H_2^{}SO_4^{} \to MgSO_4^{} + H_2^{} \uparrow $
C. $Fe + H_2^{}SO_4^{} \to FeSO_4^{} + H_2^{} \uparrow $
D. $Fe + 2HCl \to FeCl_2^{} + H_2^{} \uparrow $
Câu 7. Chất nào sau đây tác dụng với Hydrochlric acid sinh ra khí H2?
A. MgO. B. FeO. C. CaO. D. Fe.
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 | 6 | 7 |
| B | D | A | A | B | B |
D |
MỨC ĐỘ 2 : HIỂU (5 câu )
Câu 8. Trong các acid sau, acid nào có số nguyên tử Hydrogen nhiều nhất liên kết với gốc axit?
A. $HCl$. B. $H_2^{}SO_4^{}$. C. $HNO_3^{}$. D. $H_3^{}PO_4^{}$.
Câu 9. Hydrochlric acid được dùng nhiều trong ngành nào?
A. Nông nghiệp. B. Công nghiệp. C. Du lịch. D. Y tế.
Câu 10. Dãy chất nào chỉ gồm các acid?
A. HCl; NaOH. B. CaO; H2SO4. C. H3PO4; HNO3. D. SO2; KOH.
Câu 11. Acid H2SO4 loãng tác dụng với Fe tạo thành sản phẩm:
A. Fe2(SO4)3 và H2. B. FeSO4 và H2.
C. FeSO4 và SO2. D. Fe2(SO4)3 và SO2.
Câu 12. Để pha loãng H2SO4 đặc cách làm nào sau đây đúng?
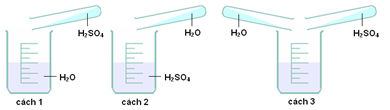
A. cách 1. B. cách 2. C. cách 3. D. cách 1 và 2.
ĐÁP ÁN
|
8 |
9 | 10 | 11 | 12 |
| D | B | C | B |
A |
MỨC ĐỘ 3: VẬN DỤNG (3 câu)
Câu 13. Phản ứng nào sau đây không xảy ra?
A. 2Al + 3H2SO4 $ \to $ Al2(SO4)3 + 3H2. B. 2Na + H2SO4 $ \to $ Na2SO4 + H2.
C. Cu + H2SO4 $ \to $ CuSO4 + H2. D. Zn + H2SO4 $ \to $ ZnSO4 + H2.
Câu 14. Phản ứng nào sau đây không đúng?
A. 2Al +3H2SO4 $ \to $ Al2(SO4)3 +3H2. B. 2Fe + 3H2SO4 $ \to $ Fe2(SO4)3 + 3H2.
C. Fe + H2SO4 $ \to $ FeSO4 + H2. D. Pb + H2SO4 $ \to $ PbSO4 + H2.
Câu 15. Dãy gồm các kim loại phản ứng được với dung dịch H2SO4 loãng là:
A. Fe, Mg, Zn, Cu. B. Na, Ba, Cu, Ag. C. Ba, Mg, Fe, Zn. D. Fe, Al, Ag, Pt.
Để giải quyết câu hỏi 13,14,15: lưu ý một số kim loại không phản ứng với acid loãng như: Cu; Ag; Pt, Au,…
ĐÁP ÁN
|
13 |
14 | 15 |
| C | B |
C |