Đề kiểm tra cuối HK1 môn Hóa 10 Chân trời sáng tạo có đáp án-Đề 10 được soạn dưới dạng file Word và PDF gồm 3 trang. Các bạn xem và tải về ở dưới.
A. TRẮC NGHIỆM (5,0 điểm)
Câu 1. Phát biểu nào sau đây về nguyên tố phosphorus (Z=15) là sai?
A. Có 3 electron hóa trị.
B. Vị trí ô số 15 trong bảng tuần hoàn các nguyên tố hóa học.
C. Thuộc nguyên tố phi kim.
D. Công thức oxide cao nhất là P2O5.
Câu 2. Nguyên tử nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm neon khi tham gia hình thành liên kết hóa học?
A. Chlorine. B. Hydrogen. C. Fluorine. D. Sulfur.
Câu 3. Cho các ion sau: Ca2+, Cl–, Al3+ và S2-. Số ion có cấu hình electron của khí hiếm agron là
A. 4. B. 3. C. 1. D. 2.
Câu 4. Tìm phát biểu đúng?
A. Liên kết ion được hình thành giữa phân tử phân cực với phân tử phân cực khác.
B. Liên kết ion được hình thành do lực hút giữa một nguyên tử với một nguyên tử khác
C. Liên kết ion được hình thành do lực hút giữa một phân tử với một phân tử khác.
D. Liên kết ion được hình thành do lực hút tĩnh điện giữa ion dương và ion âm.
Câu 5. Nguyên tố hóa học là tập hợp các nguyên tử có cùng
A. số hạt neutron và proton. B. số khối A.
C. điện tích hạt nhân. D. số hạt neutron.
Câu 6. Orbital nguyên tử là
A. đám mây chứa electron có dạng hình số 8 nổi.
B. khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất.
C. quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước và năng lượng xác định.
D. đám mây chứa electron có dạng hình cầu.
Câu 7. Phát biểu đúng về định luật tuần hoàn là
A. Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
B. Tính chất của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
C. Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của số lớp electron.
D. Tính chất của các nguyên tố và đơn chất biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Câu 8. Trong một nhóm, bán kính nguyên tử của nguyên tử các nguyên tố có xu hướng
A. tăng theo chiều tăng của tính phi kim. B. giảm theo chiều tăng của điện tích hạt nhân.
C. tăng theo chiều giảm của điện tích hạt nhân. D. tăng theo chiều tăng của tính kim loại.
Câu 9. Sự hình thành ion của nguyên tử Mg (Z = 12) theo quy tắc octet được mô tả
A. Mg + 6e ⟶ Mg6−. B. Mg + 2e ⟶ Mg2−. C. Mg ⟶ Mg2++ 2e. D. Mg + 2e ⟶ Mg2+.
Câu 10. Trong nguyên tử, hạt có khối lượng và không mang điện tích là
A. hạt nhân. B. proton. C. neutron. D. electron.
Câu 11. Đồng vị của cùng một nguyên tố hóa học là tập hợp các
A. nguyên tố có cùng số neutron, khác nhau số proton.
B. nguyên tố có cùng số proton, khác nhau số neutron.
C. nguyên tử có cùng số proton, khác nhau số neutron.
D. nguyên tử có cùng số neutron, khác nhau số proton.
Câu 12. Liên kết giữa hai nguyên tử được hình thành bởi một cặp electron chung được gọi là
A. liên kết đơn. B. liên kết ba. C. liên kết đôi. D. liên kết bội.
Câu 13. Cấu hình electron của nguyên tử của nguyên tố aluminium (Z = 13) theo ô orbital là
A.![]() B.
B.![]() C.
C.![]() D.
D.![]() Câu 14. Trong một chu kì, theo chiều điện tích hạt nhân tăng dần thì
Câu 14. Trong một chu kì, theo chiều điện tích hạt nhân tăng dần thì
A. tính kim loại tăng, tính phi kim tăng.
B. tính kim loại giảm, tính phi kim tăng.
C. tính kim loại tăng, tính phi kim giảm.
D. tính kim loại giảm, tính phi kim giảm.
Câu 15. Số thứ tự của một ô nguyên tố bằng
A. số electron lớp ngoài cùng của nguyên tử nguyên tố hóa học trong ô đó.
B. số lớp electron nguyên tử của nguyên tố hóa học trong ô đó.
C. số khối của nguyên tố hóa học trong ô đó.
D. số hiệu nguyên tử của nguyên tố hóa học trong ô đó.
B. TỰ LUẬN (5,0 điểm)
Câu 1. (2,0 điểm): Ở hình bên là phân tử cafein, một chất gây đắng tìm thấy trong cafe, trà.
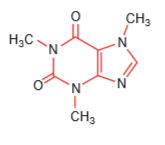
a. Viết cấu hình electron và nêu vị trí các nguyên tố H, O trong bảng tuần hoàn các nguyên tố hóa học.
b. So sánh tính phi kim của 3 nguyên tố C, N, O; giải thích.
c. Hãy lập công thức oxide ứng với hóa trị cao nhất và công thức hydroxide tương ứng của một nguyên tố có trong cafein mà nguyên tử liên kết với các nguyên tử xung quanh còn 1 cặp electron tự do.
Câu 2. (2,0 điểm):
a. Mô tả sự hình thành ion của nguyên tử nguyên tố calcium (Z=20) theo quy tắc octet?
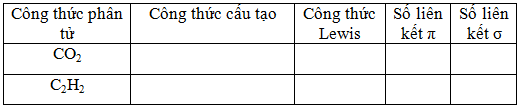
b. Điền các thông tin còn thiếu vào ô tương ứng.

c. Sodium sulfide (Na2S) đã được chứng minh có vai trò trong bảo vệ tim mạch, chống lại chứng thiếu máu cục bộ, giúp bảo vệ phổi. Trình bày sự hình thành liên kết ion trong phân tử sodium sulfide.
Câu 3. (1,0 điểm)
Các chất thường dùng trong đời sống như muối ăn (NaCl), bột ngọt (C5H8NO4Na), chất bảo quản thực phẩm (C7H5O2Na) đều có chứa ion sodium. Hiệp hội Tim mạch Hoa Kỳ khuyến cáo người trưởng thành mỗi ngày cần dùng từ 500mg đến 2300mg để đảm bảo sức khỏe.
a. Một người trưởng thành dùng trung bình một ngày gồm 5,0 gam muối ăn; 6,0 gam bột ngọt và 0,1 gam chất bảo quản. Tính lượng sodium người ấy đã tiêu thụ hàng ngày?
b. Đối với trường hợp trên thì lượng sodium tiêu thụ có vượt mức giới hạn cho phép hay không?
—– HẾT ——
ĐÁP ÁN
I. PHẦN TRẮC NGHIỆM
| 1 | 2 | 3 | 4 | 5 |
| A | C | B | D | C |
| 6 | 7 | 8 | 9 | 10 |
| B | A | D | C | C |
| 11 | 12 | 13 | 14 | 15 |
| C | A | A | B | D |
II. PHẦN TỰ LUẬN
Câu 1. (2,0 điểm): Ở hình bên là phân tử cafein, một chất gây đắng tìm thấy trong cafe, trà.
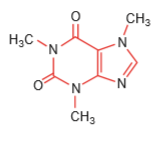
a. Viết cấu hình electron và nêu vị trí các nguyên tố H, O trong bảng tuần hoàn các nguyên tố hóa học.
b. So sánh tính phi kim của 3 nguyên tố C, N, O; giải thích.
c. Hãy lập công thức oxide ứng với hóa trị cao nhất và công thức hydroxide tương ứng của một nguyên tố có trong cafein mà nguyên tử liên kết với các nguyên tử xung quanh còn 1 cặp electron tự do.
Lời giải:
a. Viết cấu hình electron và nêu vị trí các nguyên tố H, O trong bảng tuần hoàn các nguyên tố hóa học?
H (Z=1): 1s1
Ô: 1; chu kì: 1; nhóm: IA
O (Z=8): 1s2 2s2 2p4
Ô: 8; chu kì: 2; nhóm: IVA
b. So sánh tính phi kim của 3 nguyên tố C, N, O; giải thích.
C, N, O cùng thuộc chu kì 2 lần lượt thuộc các nhóm IVA, VA, VIA.
Theo chiều tăng dần của điện tích hạt nhân nguyên tử, tính phi kim các nguyên tố tăng dần nên tính phi kim C < N < O.
c. Hãy lập công thức oxide ứng với hóa trị cao nhất và công thức hydroxide tương ứng của một nguyên tố có trong cafein mà nguyên tử liên kết với các nguyên tử xung quanh còn 1 cặp electron tự do.
Công thức oxide ứng với hóa trị cao nhất của N: N2O5
Công thức hydroxide tương ứng N: HNO3
Câu 2. (2,0 điểm):
a. Mô tả sự hình thành ion của nguyên tử nguyên tố calcium (Z=20) theo quy tắc octet?
b. Điền các thông tin còn thiếu vào ô tương ứng.
c. Sodium sulfide (Na2S) đã được chứng minh có vai trò trong bảo vệ tim mạch, chống lại chứng thiếu máu cục bộ, giúp bảo vệ phổi. Trình bày sự hình thành liên kết ion trong phân tử sodium sulfide.
Lời giải:
a. Mô tả sự hình thành ion của nguyên tử nguyên tố calcium (Z=20) theo quy tắc octet?
Ca → Ca2+ + 2e
b. Điền các thông tin còn thiếu vào ô tương ứng.

c. Sodium sulfide (Na2S) đã được chứng minh có vai trò trong bảo vệ tim mạch, chống lại chứng thiếu máu cục bộ, giúp bảo vệ phổi. Trình bày sự hình thành liên kết ion trong phân tử sodium sulfide.
Sự hình thành liên kết ion trong phân tử sodium sulfide.
Na → Na+ + 1e
S + 2e → S2-
2Na+ + S2- → Na2S
Câu 3. (1,0 điểm)
Các chất thường dùng trong đời sống như muối ăn (NaCl), bột ngọt (C5H8NO4Na), chất bảo quản thực phẩm (C7H5O2Na) đều có chứa ion sodium. Hiệp hội Tim mạch Hoa Kỳ khuyến cáo người trưởng thành mỗi ngày cần dùng từ 500mg đến 2300mg để đảm bảo sức khỏe.
a. Một người trưởng thành dùng trung bình một ngày gồm 5,0 gam muối ăn; 6,0 gam bột ngọt và 0,1 gam chất bảo quản. Tính lượng sodium người ấy đã tiêu thụ hàng ngày?
b. Đối với trường hợp trên thì lượng sodium tiêu thụ có vượt mức giới hạn cho phép hay không?
Lời giải:
a. Một người trưởng thành dùng trung bình một ngày gồm 5,0 gam muối ăn; 6,0 gam bột ngọt và 0,1 gam chất bảo quản. Tính lượng sodium người ấy đã tiêu thụ hàng ngày?
Lượng sodium tiêu thụ: (5/58,5 + 6/157 + 0,1/144)x23 = 2,861 g = 2861 mg
b. Đối với trường hợp trên thì lượng sodium tiêu thụ có vượt mức giới hạn cho phép hay không?
2861mg > 2300mg nên trường hợp trên vượt mức giới hạn cho phép
Lưu ý: Học sinh giải cách khác nếu đúng vẫn cho điểm tối đa