Đề kiểm tra HK2 Hóa 10 Chân trời sáng tạo-Đề 5 được soạn dưới dạng file word và PDF gồm 3 trang. Các bạn xem và tải về ở dưới.
ĐỀ KIỂM TRA HÓA 10 CHÂN TRỜI SÁNG TẠO HỌC KỲ II-ĐỀ 5
Cho biết Nguyên tử khối của: Na =23; Br = 80; Cl = 35,5.
A. TRẮC NGHIỆM: (5,0 điểm)
Câu 1: Nhận định nào dưới đây là đúng?
A. Sự thay đổi nhiệt độ không ảnh hưởng đến tốc độ phản ứng.
B. Khi nhiệt độ giảm thì tốc độ phản ứng tăng.
C. Khi nhiệt độ tăng thì tốc độ phản ứng tăng.
D. Khi nhiệt độ tăng thì tốc độ phản ứng giảm.
Câu 2: Cho phương trình nhiệt hóa học của phản ứng:
2H2(g) + O2(g) $ \to $ 2H2O(l) ${\Delta _r}H_{298}^o$= -571,68kJ
Phản ứng trên là phản ứng
A. có sự hấp thụ nhiệt lượng từ môi trường xung quanh.
B. thu nhiệt.
C. tỏa nhiệt.
D. không có sự thay đổi năng lượng.
Câu 3: Chất khử là
A. chất có số oxi hoá giảm xuống sau phản ứng. B. chất nhường electron.
C. chất có số oxi hoá không thay đổi sau phản ứng. D. chất nhận electron.
Câu 4: Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực cảm ứng. Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của
A. các nguyên tử trong phân tử.
B. các neutron và proton trong hạt nhân.
C. các proton trong hạt nhân.
D. các electron trong phân tử.
Câu 5: Ở điều kiện thường, đơn chất chlorine có màu
A. đen tím. B. lục nhạt. C. vàng lục. D. nâu đỏ.
Câu 6: Trong hợp chất H2S, số oxi hóa của sulfur (lưu huỳnh) là
A. +1. B. -1. C. +2. D. -2.
Câu 7: Cho phản ứng hoá học sau: Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g).
Ban đầu nồng độ của HCl là 0,8M, sau 40 giây nồng độ của HCl là 0,6M. Tốc độ trung bình của phản ứng theo HCl trong 40 giây là
A. 5.10-3 M/s. B. 2.10-3 M/s. C. 1,5.10-3 M/s. D. 2,5.10-3 M/s.
Câu 8: Ở điều kiện thường, đơn chất halogen nào sau đây tồn tại ở thể lỏng?
A. F2. B. Cl2. C. I2. D. Br2.
Câu 9: Các nguyên tố halogen trong bảng tuần hoàn thuộc nhóm
A. VA. B. IIA. C. VIIA. D. VIA.
Câu 10: Điều kiện nào sau đây là điều kiện chuẩn đối với chất khí?
A. Áp suất 1 bar và nhiệt độ 25oC hay 298K.
B. Áp suất 1 bar và nhiệt độ 25K.
C. Áp suất 1 atm và nhiệt độ 0oC.
D. Áp suất 1 bar và nhiệt độ 0oC.
Câu 11: Cho các quá trình hoá học sau:
(a) Nhiệt phân Cu(OH)2 tạo thành CuO.
(b) Đốt cháy than trong không khí.
(c) Quá trình quang hợp.
(d) Hoà tan viên vitamin C sủi vào cốc nước.
Số quá trình thu nhiệt là
A. 2. B. 4. C. 3. D. 1.
Câu 12: Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây?
A. Cân bằng hoá học. B. Tốc độ phản ứng.
C. Phản ứng thuận nghịch. D. Phản ứng một chiều.
Câu 13: Phát biểu nào dưới đây không đúng?
Phản ứng oxi hoá − khử là phản ứng
A. có sự thay đổi số oxi hoá của một số nguyên tố.
B. có sự chuyển dịch electron giữa các chất phản ứng.
C. có sự thay đổi số oxi hoá của tất cả các nguyên tố.
D. luôn xảy ra đồng thời sự oxi hoá và sự khử.
Câu 14: Cho các yếu tố sau: nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác. Trong những yếu tố trên, có bao nhiêu yếu tố ảnh hưởng đến tốc độ phản ứng?
A. 2. B. 3. C. 5. D. 4.
Câu 15: Cho enthalpy tạo thành chuẩn của một số chất như sau:
| Chất | CO(g) | H2O(g) |
| ${\Delta _f}H_{298}^o$(kJ/mol) | -110,50 | -241,80 |
Biến thiên enthalpy chuẩn của các phản ứng: C(graphite) + H2O(g) $\xrightarrow{{{t^o}}}$ CO(g) + H2(g)
có giá trị là
A. -175,34kJ. B. +131,30 kJ. C. +145,90 kJ. D. -183,60 kJ.
B. TỰ LUẬN: (5,0 điểm)
Câu 1 (2,0 điểm):
a. Cho phản ứng oxi hóa khử sau: Cu + HNO3 $ \to $ Cu(NO3)2 + NO + H2O.
Cân bằng phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron và chỉ rõ chất khử, chất oxi hoá, quá trình oxi hóa, quá trình khử.
b. Cho năng lượng liên kết của các chất tương ứng trong phương trình.
| Liên kết | N ≡ N | H-H | H-N |
| Eb (kJ/mol) | 945 | 432 | 391 |
Tính biến thiên enthalpy chuẩn của phản ứng 3H2(g) + N2(g) → 2NH3
Câu 2 (2,0 điểm):
a. Cho phản ứng đơn giản sau: 2NO(g) + O2(g)$ \to $ 2NO2(g)
Viết biểu thức tốc độ tức thời của phản ứng. Ở nhiệt độ không đổi, tốc độ phản ứng thay đổi như thế nào khi nồng độ NO tăng 2 lần, nồng độ O2 không đổi? Giải thích.
b. Cho 2 mẫu BaSO3 có khối lượng bằng nhau vào 2 cốc chứa 50ml dung dịch HCl 0,1M như hình sau:
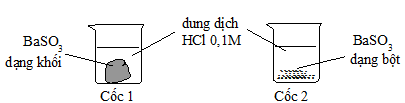
– Cốc nào mẫu BaSO3 tan nhanh hơn? Giải thích.
– Thêm 10 ml dung dịch HCl 0,1 M vào 2 cốc thì tốc độ phản ứng có thay đổi hay không? Vì sao?
Câu 3 (1,0 điểm): Bromine là nguyên liệu điều chế các hợp chất chứa bromide trong y dược, nhiếp ảnh, chất nhuộm, chất chống nổ cho động cơ đốt trong, thuốc trừ sâu,… Để sản xuất bromine từ nguồn nước biển có hàm lượng 82,4 gam NaBr/m3 nước biển người ta dùng phương pháp thổi khí chlorine vào nước biển. Lượng khí chlorine cần dùng phải nhiều hơn 10% so với lí thuyết. Tính khối lượng khí chlorine cần dùng để điều chế bromine có trong 1200 m3 nước biển.
Học sinh được sử dụng bảng tuần hoàn các nguyên tố hóa học
ĐÁP ÁN
I. TRẮC NGHIỆM
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| C | C | B | D | C | D | D | D |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| C | A | C | B | C | C | B |
II. TỰ LUẬN
| CÂU | ĐÁP ÁN | ĐIỂM |
| 1 | a/ 1,0 đ
B1: Xác định đúng số oxi hóa và chỉ ra chất khử, chất oxi hóa : B2: Viết quá trình oxi hóa và quá trình khử : B3, B4: Cân bằng 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O b/ 1,0 đ Công thức: = Eb(N ≡ N) + 3Eb(H-H) -2.3Eb(H-N) Thay số vào công thức tìm được = -105 kJ thiếu đơn vị trừ 0,25đ |
0,5 đ
0.25 đ 0,25 đ 0,5 đ 0,5 đ |
| 2 | a/ 1,0 đ
– Viết biểu thức tốc độ tức thời: – Tốc độ phản ứng tăng 4 lần – Giải thích: b/ 1,0 đ – Mẫu BaSO3 cốc 2 tan nhanh hơn do diện tích tiếp xúc lớn hơn – Tốc độ phản ứng không thay đổi vì tốc độ phản ứng không phụ thuộc vào thể tích. |
0,5 đ
0,25 đ 0,25 đ 0,5 đ 0,5 đ |
| 3
(1,0đ) |
Số mol NaBr trong 1200m3 nước biển:
82,4 x 1200/ 103 = 960 mol Cl2 + 2NaBr $\xrightarrow{{}}$ 2NaCl + Br2 Số mol Cl2 = ½ số mol NaBr = 480 mol Khối lượng Cl2= 480 x 71 = 34080 gam Khối lượng Cl2 cần dùng= 34080 x 110/ 100 = 37488 gam |
0,25 đ
0,25 đ 0,25 đ 0,25 đ |