Đề kiểm tra HK1 Hóa 10 Chân trời sáng tạo có đáp án-Đề 4 được soạn dưới dạng file Word và PDF gồm 2 trang. Các bạn xem và tải về ở dưới.
I. TRẮC NGHIỆM (5,0 điểm)
Câu 1: Hãy cho biết quá trình Fe2+ → Fe3+ + 1e được gọi là quá trình gì?
A. Oxi hóa. B. Tự oxi hóa – khử. C. Nhận proton. D. Khử.
Câu 2: Electron cuối cùng của nguyên tử 13Al có bộ 4 số lượng tử là (qui ước electron phân bố vào các orbital trong phân lớp theo thứ tự mℓ từ -ℓ đến +ℓ)
A. n = 3; ℓ = 1; mℓ = +1; ms = +½. B. n = 3; ℓ = 1; mℓ = +1; ms = -½. C. n = 3; ℓ = 2; mℓ = +1; ms = -½. D. n = 3; ℓ = 1; mℓ = -1; ms = +½.
Câu 3: Trong các hydroxide sau đây, hydroxide nào mạnh nhất?
A. NaOH. B. Mg(OH)2. C. Be(OH)2. D. Al(OH)3.
Câu 4: Trong tự nhiên, một nguyên tử ${}_{88}^{226}Ra$ tự động phân rã ra một hạt nhân nguyên tử ${}_2^4He$ và một hạt nhân nguyên tử X. X là
A. ${}_{88}^{134}Ra$. B. ${}_{88}^{222}Ra$. C. ${}_{86}^{136}Rn$. D. ${}_{86}^{222}Rn$.
Câu 5: Liên kết nào sau đây phân cực nhất? Cho biết độ âm điện của các nguyên tố tăng theo thứ tự H, C, Br, Cl, F.
A. C-Cl. B. C-H. C. C-F. D. C-Br.
Câu 6: Phóng xạ có hạt nhân con tiến một ô so với hạt nhân mẹ là
A. phóng xạ α. B. phóng xạ β+. C. phóng xạ γ. D. phóng xạ β–.
Câu 7: Hai nguyên tố X, Y đứng kế nhau trong cùng một chu kì của bảng tuần hoàn có tổng số đơn vị điện tích hạt nhân là 25. Hai nguyên tố A, B là?
A. Mg, Al. B. Na, Mg. C. N, O. D. P, S.
Câu 8: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p – p?

Sơ đồ thể hiện sự xen phủ p – p
A. HCl. B. Cl2. C. H2. D. NH3.
Câu 9: Cho các nguyên tố: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là
A. N > Si > Mg > K. B. Mg > K > Si > N.
C. K > Mg > N > Si. D. K > Mg > Si > N.
Câu 10: Ion X2+ có cấu hình electron lớp ngoài cùng là 2s22p6. Vị trí của X trong bảng hệ thống tuần hoàn là
A. chu kỳ 2, nhóm VIIIA. B. chu kỳ 3, nhóm IIA.
C. chu kỳ 2, nhóm VIA. D. chu kỳ 3, nhóm IVA.
Câu 11: Liên kết hoá học giữa các nguyên tử trong phân tử H2O là liên kết
A. Ion. B. Hydrogen. C. Cộng hoá trị không phân cực. D. Cộng hoá trị có cực.
Câu 12: Trong phản ứng: MnO2 + 4HCl $\xrightarrow{{{t^o}}}$ MnCl2 + Cl2 + 2H2O, vai trò của HCl là
A. Tạo môi trường. B. Chất oxi hóa. C. Vừa là chất khử vừa là môi trường. D. Chất khử.
Câu 13: Cho các nguyên tử sau: $_2^5X, _3^7Y, _4^9Z, _5^{11}M, _5^{12}T$. Những nguyên tử đồng vị của nhau là
A. Y và Z. B. M và T. C. X và M. D. X và T.
Câu 14: Ở trạng thái cơ bản, nguyên tử của nguyên tố nào dưới đây có electron độc thân? (Cho số hiệu nguyên tử: ZHe = 2, ZNe = 10, ZB = 5, ZMg = 12)
A. Helium. B. Magnesium. C. Neon. D. Boron.
Câu 15: Phân tử nào dưới đây “không tuân theo” quy tắc octet?
A. CH4. B. NH3. C. H2S. D. PCl5.
II. TỰ LUẬN (5,0 điểm)
Câu 1: (2,0 điểm) X là một trong những nguyên tố có trong thành phần của nhựa PVC, các chất dẻo hay cao su. Ngoài ra, với tính oxi hóa mạnh, hợp chất của X còn được dùng để khử trùng nước sinh hoạt, điều chế nước Javen – sản phẩm được dùng để tẩy trắng quần áo, vải sợi, …
a) Ở trạng thái cơ bản X có 11 electron thuộc các phân lớp p. Viết cấu hình electron của X.
b) Dựa trên cấu hình electron, cho biết vị trí của X trong bảng hệ thống tuần hoàn.
c) Trong tự nhiên X có hai đồng vị hơn kém nhau hai neutron. Trong đồng vị số khối lớn, số hạt mang điện gấp 1,7 lần hạt không mang điện. Xác định thành phần cấu tạo của hai đồng vị và thành phần phần trăm của mỗi đồng vị trong tự nhiên biết nguyên tử khối (NTK) trung bình của X bằng 35,48. Coi NTK có giá trị bằng số khối.
Câu 2: (1,0 điểm) Xác định công thức VSEPR, trạng thái lai hóa của nguyên tố trung tâm và dạng hình học của các phân tử H2S, BCl3 (Không cần vẽ hình)
Câu 3: (1,0 điểm)
a) Cân bằng phản ứng oxi hóa – khử sau bằng phương pháp thăng bằng electron:
Cl2 + KOH $\xrightarrow{{{t^o}}}$ KCl + KClO3 + H2O
b) Cân bằng phản ứng oxi hóa – khử sau bằng phương pháp ion – electron:
K2Cr2O7 + FeSO4 + H2SO4 → Cr2(SO4)3 + Fe2(SO4)3 + K2SO4 + H2O
Câu 4: (1,0 điểm)
Đồng vị nhân tạo ${}_{27}^{60}Co$ được dùng trong y tế phân rã thành đồng vị bền là ${}_{28}^{60}Ni.$
a) Viết phương trình hóa học của phản ứng phân rã hạt nhân Cobalt-60 nói trên.
b) Biết chu kỳ bán hủy ${}_{27}^{60}Co$ thành ${}_{28}^{60}Ni$là 5,33 năm. Giả sử mẫu ban đầu có 3,42mg Cobalt-60 thì sau 10 năm, lượng Cobalt-60 còn lại là bao nhiêu?
—— HẾT ——
Học sinh được sử dụng bảng hệ thống tuần hoàn các nguyên tố hóa học.
ĐÁP ÁN
I. PHẦN TRẮC NGHIỆM
| 1 | 2 | 3 | 4 | 5 |
| A | D | A | D | C |
| 6 | 7 | 8 | 9 | 10 |
| D | A | B | D | B |
| 11 | 12 | 13 | 14 | 15 |
| D | C | B | D | D |
II. PHẦN TỰ LUẬN
Câu 1: (2,0 điểm)
a) Vì X có 11 electron thuộc phân lớp p
⇒ cấu hình electron phân lớp p của X là: 2p63p5
⇒ cấu hình electron đầy đủ: 1s22s22p63s23p5.
b) Vị trí của X: Ô số 17, chu kì 3, nhóm VIIA
c) Trong đồng vị số khối, số neutron (hạt không mang điện) là 34:1,7 = 20 hạt.
⇒ số neutron trong đồng vị số khối nhỏ là 18 hạt.
+ Vậy thành phần cấu tạo các đồng vị của X là:
Đồng vị số khối nhỏ: 17 electron, 17 proton, 18 neutron.
Đồng vị số khối lớn: 17 electron, 17 proton, 20 neutron.
+ Thành phần % mỗi đồng vị:
Gọi thành phần % theo số nguyên tử đồng vị nhỏ là x%
⇒ thành phần % theo số nguyên tử đồng vị lớn là (100 – x)%.
Ta có: (17+18).x% + (17+20) (100-x)% = 35,48 ⇒ x = 76%.
⇒ % 35X = 76% và % 37X = 24%
Câu 2: (1,0 điểm)
H2S: AX2E2; Trạng thái lai hóa của S là sp3. Phân tử dạng góc. (hoặc gấp khúc; chữ V)
BCl3: AX3E0; Trạng thái lai hóa của B là sp2. Tam giác.(hoặc tam giác đều hoặc phẳng)
Câu 3: (1,0 điểm)
a)
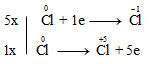
3Cl2 + 6KOH $\xrightarrow{{{t^o}}}$ 5KCl + KClO3 + 3H2O
b)
$\begin{gathered}
1x\left| {C{r_2}{O_7}^{2 – } + 14{H^ + } + 6e} \right.\xrightarrow{{}}2C{r^{3 + }} + 7{H_2}O \hfill \\
6x\left| {F{e^{2 + }}} \right.\xrightarrow{{}}F{e^{3 + }} + e \hfill \\
\end{gathered} $
=> Cr2O72- + 6Fe2+ + 14H+ → 2Cr3+ + 6Fe3+ + 7H2O
=> K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
Câu 4: (1,0 điểm)
a) ${}_{27}^{60}Co\xrightarrow{{}}{}_{28}^{60}Ni + {}_{ – 1}^0e$
b) Khối lượng Cobalt-60 còn lại sau khoảng thời gian 10 năm:
$m = {m_0}.{e^{ – \lambda t}} = 3,42 . {e^{ – \frac{{\ln 2}}{T}.t}} = 3,42 . {e^{ – \frac{{\ln 2}}{{5,33}}.10}} = 0,93(mg)$