Đề kiểm tra học kỳ 1 Hóa 10 Chân trời sáng tạo có đáp án-Đề 5 được soạn dưới dạng file Word và PDF gồm 3 trang. Các bạn xem và tải về ở dưới.
A. TRẮC NGHIỆM
Câu 1. Quan sát hình ảnh bên và cho biết hình ảnh này mô tả loại orbital nào của nguyên tử?
A. Orbital s. B. Orbital p. C. Orbital d. D. Orbital f.

Câu 2. Cho mô hình một nguyên tử như hình vẽ bên. Tên của các loại hạt cơ bản tương ứng ở vị trí (1), (2), (3) lần lượt là
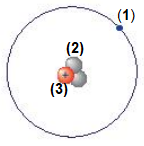
A. proton, neutron, electron. B. electron, proton, neutron.
C. electron, neutron, proton. D. neutron, electron, proton.
Câu 3. Chất nào sau đây có nhiệt độ nóng chảy cao nhất?
A. MgO. B. Nước đá. C. CO2 rắn. D. I2.
Câu 4. Nguyên tử nào sau đây là trường hợp ngoại lệ với quy tắt octet
A. H2S. B. NH3. C. HCI. D. PCl5.
Câu 5. Anion X2- có cấu hình electron lớp ngoài cùng là 3s23p6. Tổng số electron ở lớp vỏ nguyên tử X là
A. 18. B. 16. B. 9. D. 20.
Câu 6. Dãy gồm các phân tử đều có liên kết ion là
A. Cl2, Br2, I2, HCl. B. HCl, H2S, NaCl, N2O.
C. Na2O, BaCl2, Al2O3, MgCl2. D. Na2SO4, CO2, BF3.
Câu 7. Một orbital p có thể chứa tối đa bao nhiêu electron?
A. 2. B. 6. C. 10. D. 14.
Câu 8. Dãy nào sau đây xếp theo thứ tự giảm dần tính base ?
A. Si(OH)4, NaOH, Mg(OH)2, Al(OH)3. B. NaOH, Mg(OH)2, Al(OH)3, Si(OH)4.
C. Si(OH)4, Mg(OH)2, NaOH, Al(OH)3. D. Si(OH)4, Al(OH)3, Mg(OH)2, NaOH.
Câu 9. Đồng vị là những nguyên tử của cùng một nguyên tố hóa học, chúng khác nhau về
A. tính chất hóa học. B. số proton. C. số neutron. D. số electron.
Câu 10. Trong các phân tử N2, HCl, NaCl, MgO. Các phân tử có liên kết cộng hóa trị là
A. NaCl và MgO. B. HCl và MgO. C. N2 và NaCl. D. N2 và HCl.
Câu 11. Tính chất nào sau đây không phải là tính chất chung của hợp chất cộng hóa trị?
A. Có thể tồn tại ở trạng thái rắn, lỏng, khí. B. Có thể tan hoặc không tan trong nước.
C. Có nhiệt độ nóng chảy và nhiệt độ sôi thấp. D. Luôn dẫn điện ở mọi trạng thái.
Câu 12. Cho các nguyên tố sau: X (Z=6), Y (Z=9), Z (Z=14). Dãy gồm các nguyên tố được sắp xếp theo chiều tăng dần tính phi kim là
A. X, Y, Z. B. X, Z, Y. C. Y, Z, X. D. Z, X, Y.
Câu 13. Một nguyên tử của nguyên tố X có tổng số hạt proton, neutron, electron là 52 và có số khối là 35. Điện tích hạt nhân của nguyên tố X là
A. +18. B. + 17. C. 18+. D. 17+.
Câu 14. Cách biễu diễn electron vào AO ở lớp vỏ ngoài cùng của nguyên tố ( ở trạng thái cơ bản) không đúng là
A. (Aluminum)
![]() B. (Phosphorus)
B. (Phosphorus)
![]()
C. (Chlorine)
![]() D. (Silicon)
D. (Silicon)
![]()
Câu 15. Sự phân bố electron vào AO nào sau đây là đúng theo nguyên lí Pauli và quy tắc Hund?
A.
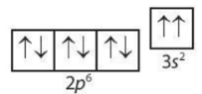 B.
B.
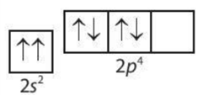 C.
C.
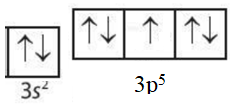 D.
D.
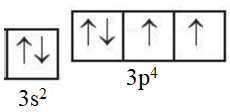
Câu 16. Quá trình nào dưới đây xảy ra sự biến đổi hóa học?
A. Sự cháy của gas (khí hóa lỏng) khi nấu ăn. B. Sự nóng lên của bàn ủi (bàn là) khi ủi quần áo.
C. Nước bị đóng băng trong ngăn đông tủ lạnh. D. Hòa tan muối và đường vào nước khi làm nước chanh.
Câu 17. Trong nguyên tử $\begin{gathered}
27 \hfill \\
13 \hfill \\
\end{gathered} $Al tổng số hạt mang điện nhiều hơn số hạt không mang điện là
A. 13 hạt. B. 14 hạt. C. 12 hạt. D. 1 hạt.
Câu 18. Cho các phát biểu sau:
(a) Electron chuyển động rất nhanh xung quanh hạt nhân không theo những quỹ đạo xác định.
(b) Các electron trên cùng một lớp có mức năng lượng bằng nhau.
(c) Số electron tối đa ở lớp L (n=2) là 8.
(d) Nguyên tử Mg (Z=12) có 1 electron ở lớp ngoài cùng.
(e) Các nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng thường là nguyên tử của nguyên tố phi kim.
Số phát biểu đúng là
A. 3. B. 5. C. 4. D. 2.
Câu 19. Cho các cấu hình electron của một số nguyên tử nguyên tố như sau: (1). ls22s22p6 ; (2). ls22s22p63s2; (3). ls22s22p63s23p63d64s2, (4). ls22s22p63s23p63d14s2. (5). ls22s22p63s23p4; (6). ls22s22p63s23p5, (7). 1s22s22p1. Số lượng các nguyên tố kim loại trong số các nguyên tố ở trên là
A. 1. B. 2. C. 3. D. 4.
Câu 20. Nguyên tử Fe có kí hiệu ${}_{26}^{56}Fe$. Cho các phát biểu sau về Fe:
(1) Nguyên tử của nguyên tố Fe có 8 electron ở lớp ngoài cùng.
(2) Nguyên tử của nguyên tố Fe có 30 neutron trong hạt nhân
(3) Fe là một phi kim
(4) Fe là nguyên tố d
Số phát biểu đúng là
A. 1. B. 2. C.3. D. 4
B. TỰ LUẬN
Câu 1. (2,5 điểm) Ở trạng thái cơ bản, nguyên tố A, X, Z có electron cuối cùng đặc trưng bằng bốn số lượng tử như sau:
A: n = 3; l = 1; ml = – 1; s = –1/2
X: n = 2; l = 1; ml = – 1; s = –1/2
Z: n = 2; l = 1; ml = 0; s = +1/2
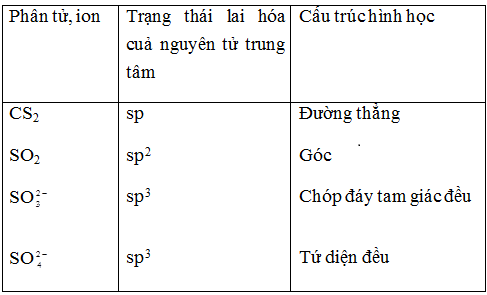
a) Xác định A, X, Z (qui ước: số lượng tử từ nhận giá trị từ thấp đến cao). Từ đó cho biết trạng thái lai hóa và cấu trúc hình học của các phân tử và ion sau: ZA2, AX2, ${\text{AX}}_3^{2 – }$, ${\text{AX}}_4^{2 – }$.
b) Bằng thuyết lai hóa giải thích sự tạo thành phân tử ZX. Giải thích vì sao ZX có moment lưỡng cực bé.
Câu 2. ( 1,5 điểm) Có nhiều vụ tai nạn giao thông xảy ra do người lái xe uống rượu. Theo luật định hàm lượng ethanol trong máu người lái xe không vượt quá 0,02% theo khối lượng. Để xác định hàm lượng ethanol trong máu của người lái xe cần chuẩn độ ethanol bằng K2Cr2O7 trong môi trường acid. Khi đó Cr+6 bị khử thành Cr+3, ethanol (C2H5OH) bị oxi hóa thành acetaldehyde (CH3CHO).
a) Hãy viết phương trình hóa học của phản ứng.
b) Khi chuẩn độ 25 g huyết tương máu của một lái xe cần dùng 20 mL dung dịch K2Cr2O7 0,01 M. Người lái xe có vi phạm luật hay không? Tại sao? Giả sử rằng trong thí nghiệm trên chỉ có ethanol tác dụng với K2Cr2O7.
Câu 3. (1 điểm) Bằng việc tính toán hãy chỉ ra trong hai phản ứng dưới đây, phản ứng nào tạo ra năng lượng lớn hơn khi tính cho một gam nhiên liệu:
Phản ứng phân hạch: ${}_{92}^{235}U + \;{}_0^1n\; \to \;{}_{40}^{94}Zr + \;{}_{58}^{140}Ce + \;6{}_{ – 1}^0e + \;2{}_0^1n$
Phản ứng nhiệt hạch: $2{}_1^2H \to {}_1^3H + \;{}_1^1H$
Biết khối lượng nguyên tử:
235,0439u cho ${}_{92}^{235}U$; 93,9061u cho ${}_{40}^{94}Zr$; 139,9053u cho ${}_{58}^{140}Ce$; 1,007825u cho ${}_1^1H$; 2,014u cho ${}_1^2H$; 3,01605 u cho ${}_1^3H$.
ĐÁP ÁN
I. PHẦN TRẮC NGHIỆM
| 1 | 2 | 3 | 4 | 5 |
| A | C | A | D | B |
| 6 | 7 | 8 | 9 | 10 |
| C | B | B | C | D |
| 11 | 12 | 13 | 14 | 15 |
| D | B | B | C | D |
| 16 | 17 | 18 | 19 | 20 |
| A | C | A | C | B |
II. PHẦN TỰ LUẬN
Câu 1. (2,5 điểm) Ở trạng thái cơ bản, nguyên tố A, X, Z có electron cuối cùng đặc trưng bằng bốn số lượng tử như sau:
A: n = 3; l = 1; ml = – 1; s = –1/2
X: n = 2; l = 1; ml = – 1; s = –1/2
Z: n = 2; l = 1; ml = 0; s = +1/2
a) Xác định A, X, Z (qui ước: số lượng tử từ nhận giá trị từ thấp đến cao). Từ đó cho biết trạng thái lai hóa và cấu trúc hình học của các phân tử và ion sau: ZA2, AX2, ${\text{AX}}_3^{2 – }$, ${\text{AX}}_4^{2 – }$.
b) Bằng thuyết lai hóa giải thích sự tạo thành phân tử ZX. Giải thích vì sao ZX có moment lưỡng cực bé.
Lời giải:
1. a) Nguyên tố A: n = 3, l = 1, ml = –1, s = –1/2 $ \to $ 3p4 nên A là S
Nguyên tố X: n = 2, l = 1, ml = –1, s = –1/2 $ \to $ 2p4 nên X là O
Nguyên tố Z: n = 2, l = 1, ml = 0, s = +1/2 $ \to $ 2p2 nên Z là C
b) 0,25 + 0,5 = 0,75đ
C: [He] 2s2 2p2
![]()
O: [He] 2s22p4
![]()
Cacbon dùng 1 obitan 2s tổ hợp với 1 obitan 2p tạo ra 2 obitan lai hóa sp hướng ra hai phía khác nhau, trong đó có một obitan chứa 2e và 1 obitan chứa 1e.
Cacbon dùng 1 obitan lai hóa chứa 1e xen phủ xichma với 1 obitan p chứa 1e của oxi và dùng 1 obitan p thuần khiết chứa 1e xen phủ pi với 1 obitan p cũng chứa 1e còn lại của oxi. Oxi dùng 1 obitan p bão hòa ( chứa 2e) xen phủ với obitan p trống của cacbon tạo liên kết pi kiểu p$ \to $ p.
Công thức cấu tạo: :C$ \equiv $ O:
CO có momen lưỡng cực bé vì trong phân tử có liên kết phối trí ngược cặp e của nguyên tử oxi cho sang obitan trống của nguyên tử cacbon làm giảm độ phân cực của liên kết nên làm giảm moment lưỡng cực.
Câu 2. ( 1,5 điểm) Có nhiều vụ tai nạn giao thông xảy ra do người lái xe uống rượu. Theo luật định hàm lượng ethanol trong máu người lái xe không vượt quá 0,02% theo khối lượng. Để xác định hàm lượng ethanol trong máu của người lái xe cần chuẩn độ ethanol bằng K2Cr2O7 trong môi trường acid. Khi đó Cr+6 bị khử thành Cr+3, ethanol (C2H5OH) bị oxi hóa thành acetaldehyde (CH3CHO).
a) Hãy viết phương trình hóa học của phản ứng.
b) Khi chuẩn độ 25 g huyết tương máu của một lái xe cần dùng 20 mL dung dịch K2Cr2O7 0,01 M. Người lái xe có vi phạm luật hay không? Tại sao? Giả sử rằng trong thí nghiệm trên chỉ có ethanol tác dụng với K2Cr2O7.
Câu 3. (1 điểm) Bằng việc tính toán hãy chỉ ra trong hai phản ứng dưới đây, phản ứng nào tạo ra năng lượng lớn hơn khi tính cho một gam nhiên liệu:
Phản ứng phân hạch: ${}_{92}^{235}U + \;{}_0^1n\; \to \;{}_{40}^{94}Zr + \;{}_{58}^{140}Ce + \;6{}_{ – 1}^0e + \;2{}_0^1n$
Phản ứng nhiệt hạch: $2{}_1^2H \to {}_1^3H + \;{}_1^1H$
Biết khối lượng nguyên tử:
235,0439u cho ${}_{92}^{235}U$; 93,9061u cho ${}_{40}^{94}Zr$; 139,9053u cho ${}_{58}^{140}Ce$; 1,007825u cho ${}_1^1H$; 2,014u cho ${}_1^2H$; 3,01605 u cho ${}_1^3H$.
Lời giải:
So sánh năng lượng tỏa ra nếu tính cho một gam nhiên liệu.
Phản ứng phân hạch:
${}_{92}^{235}U + \;{}_0^1n\; \to \;{}_{40}^{94}Zr + \;{}_{58}^{140}Ce + \;6{}_{ – 1}^0e + \;2{}_0^1n$
Độ hụt khối: ∆m = [m(${}_{92}^{235}U$) + m(${}_0^1n$)] – [m(${}_{40}^{94}Zr$) + m(${}_{58}^{140}Ce$) + 2m(${}_0^1n)$ ]
Thay số vào được ∆m = 0,2206 (u)
Năng lượng tỏa ra:
∆E = $\Delta m{c^2}$ = 0,2239 × 931,5 ×1,602×10-13 = 3,341×10-11 (J)
Tính cho một gam nhiên liệu:
Số nguyên tử ${}^{235}U$ là: $\frac{1}{{235,0439}} \times 6,022 \times {10^{23}} = 2,562 \times {10^{21}}$
Năng lượng tỏa ra khi dùng 1 gam${}^{235}U$là:
$E = 3,341 \times {10^{ – 11}} \times 2,562 \times {10^{21}} = 8,56 \times {10^{10}}$
Phản ứng nhiệt hạch: $2{}_1^2H \to {}_1^3H + \;{}_1^1H$
Độ hụt khối: ∆m = 2m(${}_1^2H$) – [m(${}_1^3H$) + m(${}_1^1H$)]
Thay số: ∆m = 2×2,014 – (3,01605 + 1,007825) = 4,125 × 10-3 (u)
Năng lượng tỏa ra:
∆E = $\Delta m{c^2}$ = 4,125 × 931,5 ×1,602×10-13 = 6,156 × 10-13 (J)
Tính cho một gam nhiên liệu:
Số nguyên tử ${}_1^2H$ là: $\frac{1}{{2,014}} \times 6,022 \times {10^{23}} = 2,99 \times {10^{23}}$ (J)
Năng lượng tỏa ra khi dùng 1 gam${}^2H$là :
$E = \frac{{6,156{\text{ }} \times {\text{ }}{{10}^{ – 13}} \times 2,99 \times {{10}^{23}}}}{2} = 9,203 \times {10^{10}}$ (J)
Vậy khi dùng 1 g ${}^2H$làm nhiên liệu thì năng lượng tỏa ra lớn hơn khi dùng 1g${}^{235}U$