Đề ôn thi HK1 Hóa 10 Chân trời sáng tạo có đáp án-Đề 3 được soạn dưới dạng file Word và PDF gồm 2 trang. Các bạn xem và tải về ở dưới.
I. TRẮC NGHIỆM (5,0 điểm)
Câu 1: Trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như của
A. nguyên tử cùng nhóm với nó. B. khí hiếm.
C. phi kim. D. kim loại kiềm.
Câu 2: Mendeleev sắp xếp các nguyên tố vào bảng dựa trên
A. mối liên hệ giữa khối lượng nguyên tử và tính chất các nguyên tố tương ứng.
B. tên gọi của các nguyên tố hóa học.
C. thời điểm khám phá ra nguyên tố hóa học.
D. cấu trúc của nguyên tử các nguyên tố hóa học.
Câu 3: Cho các hình vẽ sau, mỗi hình cầu là 1 trong các nguyên tử 9F, 17Cl, 16 S, 15 P tương ứng theo thứ tự (từ trái qua phải) là

A. F, Cl, P, S. B. P, S, Cl, F. C. F, P, S, Cl. D. Cl, S, P, F.
Câu 4: Các khí hiếm khó tham gia các phản ứng hóa học do
A. chúng có lớp vỏ electron ngoài cùng bão hòa bền vững.
B. chúng có lớp vỏ electron ngoài cùng bão hòa kém bền vững.
C. chúng có 8 electron trong nguyên tử.
D. chúng có lớp vỏ electron ngoài cùng bán bão hòa bền vững.
Câu 5: Liên kết ion được hình thành bởi lực hút tĩnh điện giữa
A. giữa nguyên tử và ion mang điện tích âm.
B. các nguyên tử trung hòa.
C. giữa nguyên tử và ion mang điện tích dương.
D. giữa các ion mang điện tích trái dấu.
Câu 6: Hiđroxide nào mạnh nhất trong các hiđroxide Al(OH)3, NaOH, Mg(OH)2, Be(OH)2:
A. NaOH B. Al(OH)3 C. Mg(OH)2 D. Be(OH)2
Câu 7: Khi hình thành liên kết cộng hóa trị trong phân tử H – F, số electron dùng chung giữa hai nguyên tử H và F là
A. 3. B. 4. C. 2. D. 1.
Câu 8: Nguyên tố X ở chu kỳ 3, nhóm VIIA, cấu hình electron ở lớp ngoài cùng của X là:
A. 3s2 3d5 B. 3s2 3p6 C. 3s2 3p5 D. 3s24p5
Câu 9: Liên kết hóa học giữa các nguyên tử trong phân tử NH3 là liên kết
A. cộng hóa trị phân cực. B. hiđro.
C. cộng hóa trị không cực. D. ion.
Câu 10: Hợp chất ion được hình thành giữa hai nguyên tố X (Z= 11) và Y(Z=9) là:
A. X2Y B. X3Y C. X3Y2 D. XY
Câu 11: Liên kết cộng hóa trị
A. là liên kết được hình thành bởi nhiều các cặp electron dùng chung giữa hai nguyên tử.
B. là liên kết được hình thành bởi một hay nhiều cặp electron dùng chung giữa hai nguyên tử.
C. là liên kết được hình thành bởi duy nhất một cặp electron dùng chung giữa hai nguyên tử.
D. là liên kết được hình thành do lực hút tĩnh điện giữa các ion trái dấu.
Câu 12: Nội dung nào dưới đây thuộc đối tượng nghiên cứu của hóa học?
A. Sự tự quay của Trái Đất quanh trục riêng.
B. Sự ra đời và phát triển của nền văn minh lúa nước.
C. Sự phá hủy tầng ozone bởi freon-12.
D. Sự vận chuyển của máu trong hệ tuần hoàn.
Câu 13: Ở lớp thứ hai (n=2) có bao nhiêu phân lớp electron?
A. 3 B. 1 C. 4 D. 2
Câu 14: Liên kết hóa học trong phân tử nào sau đây là liên kết ion?
A. HClO. B. Cl2. C. KCl. D. HCl.
Câu 15: Phát biểu nào sau đây là đúng khi nói về sự hình thành liên kết cộng hóa trị?
A. Liên kết cộng hóa trị thường được hình thành giữa các nguyên tử nguyên tố kim loại với các nguyên tử nguyên tố phi kim.
B. Liên kết cộng hóa trị thường được hình thành giữa các nguyên tử nguyên tố kim loại.
C. Liên kết cộng hóa trị thường được hình thành giữa các nguyên tử nguyên tố phi kim.
D. Liên kết cộng hóa trị thường được hình thành giữa các nguyên tử khí hiếm.
II. TỰ LUẬN (5,0 điểm)
Câu 16: (2,0 điểm) Nguyên tố Flourine (F) có Z =9.
a. Viết cấu hình electron của nguyên tử flourine và dự đoán khả năng nhường hay nhận electron của nguyên tố flourine khi tham gia các phản ứng hóa học.
b. Hãy viết công thức Lewis của phân tử F2. Xác định số electron riêng và dùng chung của nguyên tử F trong phân tử này.
c. Liên kết trong phân tử F2 thuộc loại liên kết nào. Vì sao?
Câu 17: (1,25 điểm) Trong một thí nghiệm, cho lần lượt các oxide Na2O, P2O5 vào nước, sau đó nhúng giấy quỳ tím vào dung dịch sau phản ứng, hiện tượng được ghi nhận lại như sau:
| Oxide | Hiện tượng |
| Na2O | Tan hoàn toàn trong nước, quỳ tím chuyển sang màu xanh đậm. |
| P2O5 | Tan hoàn toàn trong nước, quỳ tím chuyển sang màu đỏ |
Hãy:
a.Viết phương trình hóa học của các phản ứng trong thí nghiệm trên.
b. So sánh tính acid – base của các hydroxide ở ý (a). Từ đó rút ra nhận xét gì về xu hướng biến đổi tính base, tính acid của hydroxide theo chu kì.
Câu 18: (0,75 điểm) Cho 3,331 gam một kim loại M thuộc nhóm IA tác dụng hoàn toàn với lượng nước dư, sau phản ứng thu được 0,48 gam khí thoát ra. Xác định kim loại M.
Câu 19: (1,0 điểm) Hợp chất ion (X) có công thức là MYOm, có tổng số hạt proton là 42, trong đó ion Y có 32 electron, Y là nguyên tố thuộc chu kỳ 2. Tìm công thức phân tử của X.
———– HẾT ———-
(Học sinh được sử dụng bảng tuần hoàn các nguyên tố hoá học)
ĐÁP ÁN
I. TRẮC NGHIỆM (5,0 điểm)
| 1 | B | 6 | A | 11 | B |
| 2 | A | 7 | C | 12 | C |
| 3 | B | 8 | C | 13 | D |
| 4 | A | 9 | A | 14 | C |
| 5 | D | 10 | D | 15 | C |
II. TỰ LUẬN (5,0 điểm)
Câu 16: (2,0 điểm)
a. Cấu hình electron của F : 1s22s22p5
F có 7 electron lớp vỏ ngoài cùng, nên có xu hướng nhận thêm 1 electron để đạt lớp vỏ octet bền vững
b. Công thức Lewis của F2 :
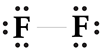
Số electron riêng của F là 6, số electron chung là 2
c. LK cộng hoá trị không phân cực.
Vì cặp e dung chung không bị lệch về phía nguyên tử nào
Câu 17:
a. Na2O + H2O → 2NaOH
P2O5 + 3H2O → 2H3PO4
b.
Tính base: NaOH > H3PO4
Tính acid: NaOH < H3PO4
| IA | VA | |
| Chu kì 3 | Na | P |
=> Trong một chu kì, theo chiều tăng của điện tích hạt nhân, tính kim loại giảm, dẫn đến tính base của hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
Câu 18:
Khối lượng H2 thoát ra = 0,48 gam , số mol H2 = 0,24 mol
Phương trình phản ứng
![]()
M = $\frac{{3,331}}{{0,48}}$ = 6,94 → M là Li
Câu 19:
MYOm : tổng e = tổng p = 42
Y có 32e nên M+ có 10e, nguyên tử M có 11p -> M là Na
ZY + 8m + 1 = 32 -> ZY = 31- 8m
Do Y thuộc chu kỳ 2 nên 3 $ \leqslant $ ZY $ \leqslant $ 9 ( trừ Ne ) nên 2,8 $ \leqslant $ m $ \leqslant $ 3,5
Chọn m = 3 thay vào được ZY = 7 -> Y là N
Vậy MYOm là NaNO3