Đề ôn thi học kỳ 1 Hóa 10 Chân trời sáng tạo có đáp án-Đề 2 được soạn dưới dạng file Word và PDF gồm 2 trang. Các bạn xem và tải về ở dưới.
I. TRẮC NGHIỆM (5 ĐIỂM).
Câu 1: Các đồng vị của nhau có cùng
A. số khối. B. số proton. C. số neutron. D. khối lượng.
Câu 2: Nguyên tố X thuộc chu kỳ 3, nhóm VIA, cấu hình electron của X là
A. 1s22s22p63s23p5. B. 1s22s22p63s23p64s1.
C. 1s22s22p63s23p2. D. 1s22s22p63s23p4.
Câu 3: Cấu hình electron của ion K+ giống với ion hay nguyên tử nào sau đây?
A. ion Na+. B. ion Cl–. C. khí hiếm Ne. D. nguyên tử calcium.
Câu 4: Trong các nguyên tử sau: Na, Li, Cs, K. Nguyên tử có bán kính nhỏ nhất là
A. Na. B. Li. C. Cs. D. K.
Câu 5: Nguyên tố X thuộc chu kì 3, nhóm IIIA trong bảng tuần hoàn. Tính chất hoá học của nguyên tố X là
A. kim loại. B. phi kim. C. khí hiếm. D. base.
Câu 6: Chất nào dưới đây, trong phân tử chỉ gồm liên kết cộng hoá trị?
A. SO3. B. NaCl. C. Na2O. D. Al2O3.
Câu 7: Nguyên tử X có 2 đồng vị với phần trăm số nguyên tử tương ứng như sau: 12X (98,89%) và 13X (1,11%) Nguyên tử khối trung bình của X là giá trị nào dưới đây?
A. 12,032. B. 12,121. C. 12, 024. D. 12,011.
Câu 8: Liên kết thường được tạo thành giữa kim loại điển hình và phi kim điển hình là liên kết
A. cộng hóa trị. B. hiđro. C. ion. D. kim loại.
Câu 9: Số electron tối đa trong lớp thứ n (n ≤ 4) là
A. 2n. B. n+1. C. n2. D. 2n2.
Câu 10: Chỉ tiêu tự khâu dùng để khâu vết thường là sản phẩm nghiên cứu hoá học dùng trong lĩnh vực
A. xây dựng. B. y khoa. C. mỹ phẩm. D. nông nghiệp.
Câu 11: Trong bảng tuần hoàn hiện nay, số chu kì lớn là
A. 6. B. 4. C. 5. D. 7.
Câu 12: Chất nào dưới đây chỉ chứa một liên kết đơn?
A. NH3. B. CO2. C. H2. D. N2.
Câu 13: Đơn vị khối lượng nguyên tử bằng x lần khối lượng nguyên tử carbon – 12. Giá trị của x là
A. 1. B. 12. C. 1/12. D. 3/4.
Câu 14: Khi tham gia liên kết hóa học, nguyên tử sodium (Na) có khuynh hướng
A. nhường 1 electron. B. nhận 1 electron.
C. nhường 1 proton. D. nhận 1 proton.
Câu 15: Nguyên tố R có tổng số hạt (e, p, n) trong nguyên tử là 58. Trong đó tổng số hạt mang điện tích dương ít hơn hạt không mang điện là 1. Vậy tổng số hạt trong hạt nhân của nguyên tử R là
A. 39. B. 36. C. 20. D. 19.
II. TỰ LUẬN (5 ĐIỂM)
Câu 1: (1,5 điểm) Cho nguyên tử N (Z=7). Hãy
a) Viết cấu hình electron của nguyên tử N. Xác định vị trí của N trong bảng tuần hoàn. Giải thích?
b) Nguyên tố N có tính kim loại, phi kim hay khí hiếm? Vì sao?
c) Phân bố các electron vào các AO. Xác định số electron độc thân của N.
Câu 2: (1 điểm) Oxide cao nhất của nguyên tố R có dạng RO2. Trong hợp chất khí với hydrogen của nguyên tố đó có 25% H về khối lượng . Xác định nguyên tố R?
Câu 3: (1,5 điểm)
a) Viết công thức electron, công thức Lewis, công thức cấu tạo của các chất sau: N2; H2SO4.
b) Dựa vào giá trị độ âm điện trong bảng tuần hoàn. Em hãy tính hiệu độ âm điện trong phân tử NH3, CaCl2 và cho biết loại liên kết của chúng?
Câu 4: (1 điểm) Hòa tan hết a gam oxit kim loại M (thuộc nhóm IIA) bằng một lượng vừa đủ dung dịch H2SO4 20% thu được dung dịch muối có nồng độ 24,91%. Xác định công thức oxit kim loại M?
(Học sinh được sử dụng bảng tuần hoàn các nguyên tố hóa học).
ĐÁP ÁN
I. TRẮC NGHIỆM (5,0 điểm)
| 1.B | 2.D | 3.B | 4.B | 5.A |
| 6.A | 7.D | 8.C | 9.D | 10.B |
| 11.B | 12.C | 13.C | 14.A | 15.A |
II. TỰ LUẬN (5,0 điểm)
Câu 1: Mỗi câu đúng 0,5 điểm
Câu 2: R là Carbon (C)
Câu 3:
a) 1 phân tử đúng đủ 3 công thức 0,5 điểm
b) Mỗi chất đúng hiệu độ âm điện và loại liên kết là 0,25 điểm
Câu 4:
Gọi số mol oxit MO = x mol.
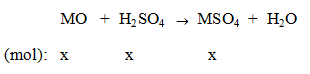
Ta có: (M + 16)x = a
Khối lượng dung dịch axit H2SO4 ban đầu = (98x.100)/(20) = 490x (gam).
Khối lượng dung dịch sau phản ứng = a + 490x = (M + 16)x + 490x.
Theo bài: C% (MSO4) = 24,91% nên: (M+ 96)x/((M+16)x+ 490x) = 0,2491
Từ đây tìm được M = 40 (Ca). Oxit kim loại cần tìm là CaO.