Đề ôn thi học kỳ 1 môn Hóa 10 Chân trời sáng tạo có đáp án-Đề 1 được soạn dưới dạng file Word và PDF gồm 3 trang. Các bạn xem và tải về ở dưới.
A. TRẮC NGHIỆM (5 điểm)
Câu 1: Nhận định nào sau đây không đúng?
A. Tất cả các hạt nhân nguyên tử đều chứa proton và neutron.
B. Nguyên tử có kích thước vô cùng nhỏ và trung hòa về điện.
C. Lớp vỏ nguyên tử chứa electron mang điện tích âm.
D. Khối lượng nguyên tử hầu hết tập trung ở hạt nhân.
Câu 2: Cặp nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học?
A. ${}_7^{14}G;\,{}_8^{16}M$. B. ${}_8^{16}M;{}_{11}^{22}D\,$. C. ${}_7^{15}E;{}_{10}^{22}Q\,$. D. ${}_8^{16}M;{}_8^{17}N$
Câu 3: Kí hiệu hóa học của Phosphorus (số proton = 15 và số neutron = 16) là
A. $\;{}_{15}^{32}P$. B. ${}_{15}^{31}P$. C. $\;{}_{16}^{32}P.\;$ D. ${}_{16}^{31}P$
Câu 4: Trong các quá trình dưới đây, đâu là hiện tượng hoá học?
A. Sự đông đặc của mỡ động vật. B. Quá trình bẻ đôi viên phấn.
C. Quá trình lên men rượu. D. Quá trình ra mực của bút bi.
Câu 5: Orbital nguyên tử là
A. đám mây chứa electron dạng hình cầu.
B. đám mây chứa electron có dạng hình số 8 nổi.
C. khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất (khoảng 90%).
D. quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước và năng lượng xác định.
Câu 6: Phát biểu nào sau đây đúng?
A. Những electron ở lớp L có mức năng lượng thấp nhất.
B. Mỗi orbital nguyên tử chứa tối đa 2 electron và có chiều tự quay ngược nhau.
C. Electron ở orbital 3p có mức năng lượng thấp hơn electron ở orbital 3s.
D. Các electron trong cùng một lớp có năng lượng bằng nhau.
Câu 7: Số hiệu nguyên tử của nguyên tố hóa học bằng
A. số thứ tự của ô nguyên tố. B. số thứ tự của chu kì.
C. số electron lớp ngoài cùng của nguyên tử. D. số thứ tự của nhóm.
Câu 8: Các nguyên tố xếp cùng một cột
A. có cấu hình electron tương tự nhau. B. có cùng số lớp electron.
C. có cùng khối lượng nguyên tử. D. có cùng đơn vị điện tích hạt nhân.
Câu 9: Nguyên tố có độ âm điện lớn nhất là
A. Sodium (Na). B. Hydrogen (H). C. Chlorine (Cl) D. Fluorine (F).
Câu 10: Trong một nhóm A, theo chiều từ trên xuống dưới, bán kính nguyên tử của các nguyên tố
A. tăng dần. B. giảm dần.
C. không thay đổi. D. biến đổi không theo quy luật.
Câu 11: Cấu hình electron của nguyên tử có Z = 15 là 1s23s22p63s23p3. Số electron lớp ngoài cùng của Z là
A. 3. B. 4. C. 5. D. 6.
Câu 12: Một nguyên tố có cấu hình electron nguyên tử là 1s22s22p63s23p1. Vị trí của nguyên tố đó trong bảng tuần hoàn là
A. nhóm IA, chu kì 3. B. nhóm IIIA, chu kì 3.
C. nhóm IIA, chu kì 6. D. nhóm IIA, chu kì 7.
Câu 13: Nguyên tố Chlorine có số hiệu nguyên tử là 17. Nguyên tố Chlorine là
A. kim loại. B. phi kim. C. kim loại hoặc phi kim. D. khí hiếm.
Câu 14: Sắp xếp theo chiều tăng dần tính base của các hydroxide sau?
A. NaOH < Al(OH)3< Mg(OH)2. B. Al(OH)3< Mg(OH)2< NaOH.
C. Mg(OH)2< NaOH < Al(OH)3. D. Mg(OH)2< Al(OH)3< NaOH.
Câu 15: Nguyên tử của nguyên tố nào sau đây có xu hướng đạt cấu hình bền vững của khí hiếm Neon khi tham gia hình thành liên kết?
A. Fluorine. B. Clorine. C. Bromine. D. Sulfur.
Câu 16: Biểu diễn sự hình thành ion nào sau đây đúng?
A. Na + 1e → Na+ B. O → O2- + 2e
C. Al → Al3+ + 3e D. Br + 2e → Br2-
Câu 17: Liên kết ion là loại liên kết hoá học được hình thành nhờ lực hút tĩnh điện giữa các phần tử nào sau đây?
A. Cation và anion. B. Các anion.
C. Cation và các electron tự do. D. Electron và hạt nhân nguyên tử.
Câu 18: Nguyên tử của nguyên tố R có 3 electron thuộc phân lớp 3d. Vị trí của nguyên tố R trong bảng tuần hoàn là vị trí nào sau đây?
A. Ô 23, chu kì 4, nhóm VB. B. Ô 25, chu kì 4, nhóm VA.
C. Ô 24, chu kì 4, nhóm VIB. D. Ô 21, chu kì 3, nhóm IIIA.
Câu 19: Để đạt quy tắc octet, nguyên tử của nguyên tố Aluminium (Z = 13) phải
A. nhường 3 electron. B. nhường 5 electron. C. nhận 3 electron. D. nhận 5 electron.
Câu 20: Phân tử có chứa liên kết ion là
A. HCl. B. I2. C. H2O. D. Na2O.
B. TỰ LUẬN (5,0 điểm)
Câu 1 (1,5 điểm): Nguyên tử X có kí hiệu ${}_{16}^{32}X$.
a) Viết cấu hình electron của nguyên tử X và nêu vị trí của X trong bảng tuần hoàn.
b) X là kim loại, phi kim hay khí hiếm. Giải thích? Xác định công thức oxide ứng với hoá trị cao nhất.
Câu 2 (1,0 điểm): Nguyên tử khối trung bình của Bromime là 79,98. Biết Bromine có hai đồng vị là 79Br và 81Br. Tính thành phần phần trăm của mỗi loại đồng vị.
Câu 3:
a) (1,5 điểm) Magnesium chloride (MgCl2) là một chất xúc tác phổ biến trong hoá học hữu cơ. Trình bày sự hình thành phân tử MgCl2 khi cho magnesium (Mg) tác dụng với khí chlorine (Cl2).
b) (1,0 điểm) X là kim loại thuộc nhóm IIA. Cho 0,85 gam hỗn hợp gồm kim loại X và Zn tác dụng với lượng dư dung dịch HCl, sinh ra 0,336 lít khí H2 (đktc). Mặt khác, khi cho 0,95 gam X tác dụng với lượng dư dung dịch H2SO4 loãng, thì thể tích khí hydrogen sinh ra chưa đến 0,56 lít (ở đktc). Xác định kim loại X.
————- HẾT ————-
ĐÁP ÁN
A. TRẮC NGHIỆM (5,0 điểm)
| 1 | 2 | 3 | 4 | 5 |
| A | D | B | C | C |
| 6 | 7 | 8 | 9 | 10 |
| B | A | A | D | A |
| 11 | 12 | 13 | 14 | 15 |
| C | B | B | B | A |
| 16 | 17 | 18 | 19 | 20 |
| C | A | A | A | D |
B. TỰ LUẬN (5,0 điểm)
Câu 1 (1,5 điểm):
a) Nguyên tử X có kí hiệu ${}_{16}^{32}X$.
Viết cấu hình electron của nguyên tử X và nêu vị trí của X trong bảng tuần hoàn.
Cấu hình electron: 1s23s22p63s23p4
Vị trí: ô số 16, chu kì 3, nhóm VIA
b) X là kim loại, phi kim hay khí hiếm. Giải thích? Xác định công thức oxide ứng với hoá trị cao nhất.
Nguyên tố X là phi kim do có 6 electron lớp ngoài cùng, dễ thu electron để đạt cấu hình bền vững theo quy tắc octet.
Hoá trị cao nhất của X với oxygen là VI
Công thức oxide là XO3
Câu 2 (1,0 điểm): Nguyên tử khối trung bình của Bromime là 79,98. Biết Bromine có hai đồng vị là 79Br và 81Br. Tính thành phần phần trăm của mỗi loại đồng vị.
Nguyên tử khối trung bình của Bromime:
${\bar A_{Br}}$ = $\frac{{79\; \times \;a\; + \;\;81\; \times \;\left( {100 – a} \right)}}{{100}}\; = \;$79,98
=> % 79Br = 50,69%
% 81Br = 49,31%
Câu 3:
a) (1,5 điểm) Magnesium chloride (MgCl2) là một chất xúc tác phổ biến trong hoá học hữu cơ. Trình bày sự hình thành phân tử MgCl2 và tính lượng muối thu được khi cho 12g magnesium (Mg) tác dụng với 8,96 lít khí chlorine (Cl2).
Sự hình thành phân tử MgCl2
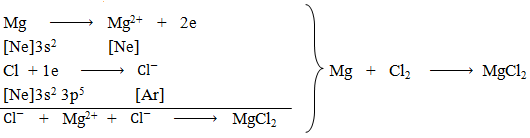
Khi cho magnesium (Mg) tác dụng với khí chlorine (Cl2), nguyên tử magnesium sẽ nhường 2 electron cho 2 nguyên tử chlorine. Mỗi nguyên tử chlorine sẽ nhận 1 electron. Kết quả có sự hình thành 1 ion Mg2+ và 2 ion $C{l^ – }$. Các ion này sẽ hút nhau theo lực hút tĩnh điện tạo thành phân tử MgCl2
b) Gọi M là kí hiệu chung của 2 kim loại X và Zn
a là số mol của M
M + 2HCl → MCl2 + H2
=> nH2 = 0,03 mol = a
→ ${\bar M_M}$ =0,85 / 0,03 = 56,67
Vì MZn = 65 > 56,67 => MX < 56,67
X + H2SO4 → XSO4 + H2
→ nX=0,85 / MX=nH2 → 0,85 / MX < 0,025
=> MX > 38
Ta có: 38 < MX < 56,67 => kim loại X là Ca