Đề kiểm tra học kỳ 1 môn Hóa 10 Chân trời sáng tạo có đáp án-Đề 6 được soạn dưới dạng file Word và PDF gồm 3 trang. Các bạn xem và tải về ở dưới.
I. Trắc nghiệm: (5 điểm)
Câu 1: Nguyên tố Cl (Z=17) thuộc chu kì
A. 4. B. 3. C. 5. D. 2.
Câu 2: Các nguyên tố xếp ở chu kì 4 có số lớp electron trong nguyên tử là
A. 5. B. 2. C. 3. D. 4.
Câu 3: Liên kết hoá học giữa các nguyên tử trong phân tử H2O là liên kết
A. ion. B. hydrogen C. cộng hoá trị phân cực. D. cộng hoá trị không phân cực.
Câu 4: Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và chu kì lớn là
A. 3 và 3. B. 4 và 3. C. 4 và 4. D. 3 và 4.
Câu 5: Trong cùng một chu kì, theo chiều số hiệu nguyên tử tăng dần, tính base của các oxide và hydroxide
A. tăng dần. B. giảm dần. C. không tăng và không giảm. D. tăng giảm không có quy luật.
Câu 6: Hạt mang điện trong hạt nhân nguyên tử là
A. neutron. B. proton và electron.
C. proton và neutron. D. proton.
Câu 7: Các hạt cấu tạo nên hầu hết các nguyên tử là
A. electron và proton. B. nơtron và proton.
C. electron, neutron và proton. D. electron và neutron.
Câu 8: Nguyên tố hóa học là tập hợp các nguyên tử có cùng
A. số electron. B. điện tích hạt nhân. C. tổng số proton và nơtron. D. số khối.
Câu 9: Độ âm điện đặc trưng cho khả năng
A. tham gia phản ứng mạnh hay yếu.
B. hút electron của nguyên tử trong phân tử.
C. nhường proton của nguyên tử này cho nguyên tử khác.
D. nhường electron của nguyên tử này cho nguyên tử khác.
Câu 10: Khi nguyên tử nhường electron sẽ tạo thành
A. cation. B. anion. C. phân tử. D. ion.
Câu 11: Liên kết cộng hóa trị là liên kết hóa học được hình thành giữa hai nguyên tử bằng
A. một electron chung. B. sự cho – nhận electron.
C. một cặp electron góp chung. D. một hay nhiều cặp electron dùng chung.
Câu 12: Hình vẽ nào sau đây đúng với nguyên lý Pauli khi điền electron vào AO?
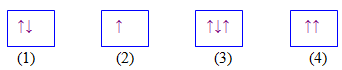 A. (2). B. (1) và (2). C. (3) và (4). D. (1).
A. (2). B. (1) và (2). C. (3) và (4). D. (1).
Câu 13: M là nguyên tố nhóm IA, oxide cao nhất của nó có công thức hóa học là
A. MO2. B. MO. C. M2O. D. M2O7.
Câu 14: Nguyên tử A có 12 electron, 12 neutron, kí hiệu nguyên tử của A là
A. ${}_{12}^{24}A$. B. ${}_{24}^{12}A$. C. ${}_{12}^{25}A$. D. ${}_{25}^{12}A$.
Câu 15: Phân lớp d có số electron tối đa là
A. 6. B. 5. C. 10. D. 14.
II. Tự Luận: (5 điểm)
Câu 1: (1,5 điểm)
Magnesium là một khoáng chất cần thiết để cơ thể có thể vận hành tốt. Magie tham gia vào hàng trăm quá trình quan trọng của cơ thể, bao gồm quá trình kiểm soát cách thức hoạt động của cơ bắp và dây thần kinh. Biết Mg ở chu kì 3, nhóm IIA
1.1. Viết cấu hình electron nguyên tử của nguyên tố Mg?
1.2. Nêu những tính chất hóa học cơ bản của Mg qua các câu hỏi sau?
+ Tính kim loại, phi kim hay khí hiếm. Giải thích?
+ Công thức oxide cao nhất
+ Công thức hydroxide tương ứng.
+ Tính chất hóa học của hydroxide.
Câu 2: (1,5 điểm)
Hợp kim chứa nguyên tố Aluminium (Al) nhẹ và bền, dùng chế tạo vỏ máy bay,…. nguyên tử nguyên tố Aluminium (Al) có tổng số các loại hạt cơ bản là 40 hạt, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Xác định số số hạt proton, neutron, electron, viết kí hiệu nguyên tử của Aluminium (Al).
2.1. Tính số hạt p, n, e có trong nguyên tử Al?
2.2. Viết KHNT của Al?
Câu 3: (0,75 điểm)
Viết công thức electron, công thức cấu tạo, công thức Lewis cho phân tử CO2 ?
Câu 4: (1,25 điểm)
Copper (Cu) là kim loại có nhiều ứng dụng trong đời sống như làm dây điện, que hàn và các đồ dùng nội thất trong nhà, đúc tượng, nam châm điện từ, các động cơ máy móc…..Trong tự nhiên, Copper có hai đồng vị là 63Cu chiếm 73% và 65Cu chiếm 27%.
4.1. Tính nguyên tử khối trung bình của Cu?
4.2. Tính số nguyên tử 63Cu có trong 15,954 gam CuSO4?
(Biết S=32; O=16; Số Avogadro = 6,02.1023)
———- Hết ———-
(Học sinh được sử dụng bảng tuần hoàn các nguyên tố hóa học. Giám thị không giải thích gì thêm)
ĐÁP ÁN
I. PHẦN TRẮC NGHIỆM
| 1 | 2 | 3 | 4 | 5 |
| B | D | C | D | B |
| 6 | 7 | 8 | 9 | 10 |
| D | C | B | B | A |
| 11 | 12 | 13 | 14 | 15 |
| D | B | C | A | C |
II. PHẦN TỰ LUẬN
Câu 1: (1,5 điểm)
1.1
Cấu hình electron của Mg: [Ne]3s2
Hoặc cấu hình electron đầy đủ 1s22s22p63s2
1.2
+ Mg là kim loại vì có 2e lớp ngoài cùng.
+ Công thức oxide cao nhất là MgO.
+ Công thức hydroxide tương ứng Mg(OH)2
+ Mg(OH)2 là một base yếu
Câu 2: (1,5 điểm)
2.1
Lập đúng hệ phương trình
2p + n = 40
2p – n = 12
Suy ra p=e=13, n=14
2.2
Số khối A = 27
KHNT 1327Al
Câu 3: (0,75 điểm)
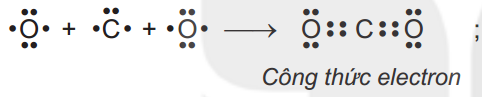
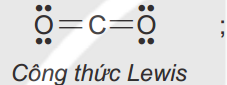
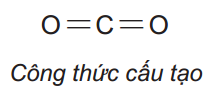
Câu 4: (1,25 điểm)
4.1
Nguyên tử khối TB của Cu = (64*73+65*27)/100 = 63,54
4.2
nCuSO4= 0,1 mol
số phân tử CuSO4 = 6,02.1022 (phân tử)
số nguyên tử 63Cu= 4,39 .1022 (nguyên tử)