Đề kiểm tra cuối học kỳ 1 Hóa 10 Chân trời sáng tạo có đáp án-Đề 8 được soạn dưới dạng file Word và PDF gồm 5 trang. Các bạn xem và tải về ở dưới.
I. TRẮC NGHIỆM: (5,0 điểm)
Câu 1: Nguyên tố $X$ ở nhóm IIIA của bảng tuần hoàn. Đặc điểm nào dưới đây hoàn toàn đúng đối với nguyên tử của $X$ ?
A. Vỏ nguyên tử có 3 electron độc thân.
B. Lớp ngoài cùng có 3 electron.
C. Vỏ nguyên tử có 3 lớp electron.
D. Vỏ nguyên tử có 3 electron.
Câu 2: Cho giá trị độ âm điện của nguyên tử các nguyên tố oxygen $\left( O \right)$, sulfur $\left( S \right)$ và fluorine $\left( F \right)$ lần lượt là: 3,$44;2,58$ và 3,98 . Dãy sắp xếp các nguyên tố trên theo thứ tự giảm dần tính phi kim (từ trái sang phải) là
A. O, F, S.
B. F, S, O.
C. O, S, F.
D. F, O, S.
Câu 3: Cho bảng dữ liệu sau:

Dữ liệu nào trong bảng trên đã mô tả sai?
A. Tên nguyên tố.
B. Số khối.
C. Số neutron.
D. Số proton.
Câu 4: Hình ảnh bên mô tả khu vực không gian xung quanh hạt nhân của nguyên tử hydrogen. Vùng không gian phía bên trong đường tròn với xác suất có mặt của electron khoảng $90\% $, được gọi là
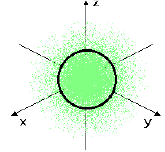
A. orbital nguyên tử.
B. phân lớp electron.
C. vỏ nguyên tử.
D. lớp electron.
Câu 5: Số lượng orbital $\left( {AO} \right)$ có trong phân lớp 2p là
A. 3 .
B. 1 .
C. 2.
D. 6 .
Câu 6: Cho giá trị bán kính (đơn vị pm, $1pm = {10^{ – 12}}\;m$ ) của ba nguyên tử $X,Y,T$ như bảng dưới đây:
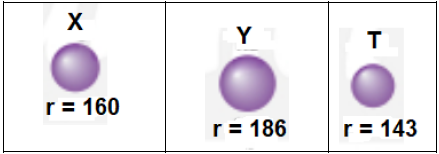
Dãy nguyên tử nào sau đây phù hợp với $X,Y,T$ ?
A. ${\;_{11}}Na,{\;_{12}}Mg,{\;_{13}}Al$.
B. ${\;_{12}}Mg,{\;_{13}}Al,{\;_{11}}Na$.
C. ${\;_{13}}Al,{\;_{11}}Na,{\;_{12}}Mg$.
D. ${\;_{12}}Mg,{\;_{11}}Na,{\;_{13}}Al$.
Câu 7: Khối các nguyên tố $p$ có kiểu cấu hình electron nào sau đây?
A. [Khí hiếm] $\left( {n – 1} \right){d^{1 \div 10}}\;n{s^{1 \div 2}}$.
B. [Khí hiếm] $\left( {n – 2} \right){f^{0 \div 14}}\left( {n – 1} \right){d^{0 \div 2}}\;n{s^2}$.
C. [Khí hiếm]ns${\;^{1 \div 2}}$.
D. [Khí hiếm]ns${\;^2}n{p^{1 \div 6}}$.
Câu 8: Công thức oxide cao nhất của các nguyên tố chu kì 3 có dạng ${{\mathbf{R}}_2}{{\mathbf{O}}_{\mathbf{n}}}$. Xét theo chiều từ trái sang phải trong chu kì 3 thì giá trị ${\mathbf{n}}$ sẽ
A. giảm dần từ 7 đến 1 .
B. tăng dần từ 1 đến 4 .
C. tăng dần từ 1 đến 7 .
D. giảm dần từ 4 đến 1 .
Câu 9: Quan sát mô hình bên (diễn tả sự hình thành phân tử $NaCl)$ và xác định phát biểu nào sau đây sai?
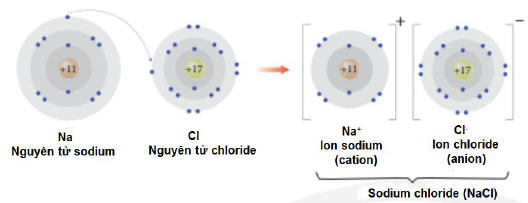
A. Nguyên tử $Cl$ đã nhận thêm một electron.
B. Ion $N{a^ + }$và $C{l^ – }$có cấu hình electron giống nhau.
C. Nguyên tử Na đã nhường đi một electron.
D. Ion $N{a^ + }$và $C{l^ – }$hút nhau bằng lực tĩnh điện.
Câu 10: Năm 1869, Mendeleev đã công bố một Bảng tuần hoàn các nguyên tố hóa học. Trong bảng này, các nguyên tố được sắp xếp vào các hàng và các cột theo chiều tăng dần của
A. số hiệu nguyên tử.
C. số neutron.
B. số khối.
D. khối lượng nguyên tử.
Câu 11: Đối với bảng tuần hoàn hiện nay, các nguyên tố hóa học có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là
A. khối nguyên tố.
B. chu kì.
C. nhóm.
D. họ nguyên tố.
Câu 12: Bảng dưới đây trình bày tính chất của các loại hạt cơ bản trong nguyên tử:

Dãy số nào dưới đây phù hợp với $x,y,t$ ?
A. $ – 1;0; + 1$.
B. $ + 1;0; – 1$.
C. $ – 1; + 1;0$.
D. $ + 1; – 1;0$.
Câu 13: Năm 1911, Rutherford sử dụng các hạt alpha (là hạt nhân của nguyên tử helium, mang điện tích +2 ) bắn vào lá vàng siêu mỏng được bao bọc bởi màn huỳnh quang để quan sát đường đi của chúng. Kết quả thí nghiệm như hình vẽ bên. Hãy cho biết từ kết quả nào của thí nghiệm đã giúp Rutherford xác nhận sự có mặt của hạt nhân trong nguyên tử.
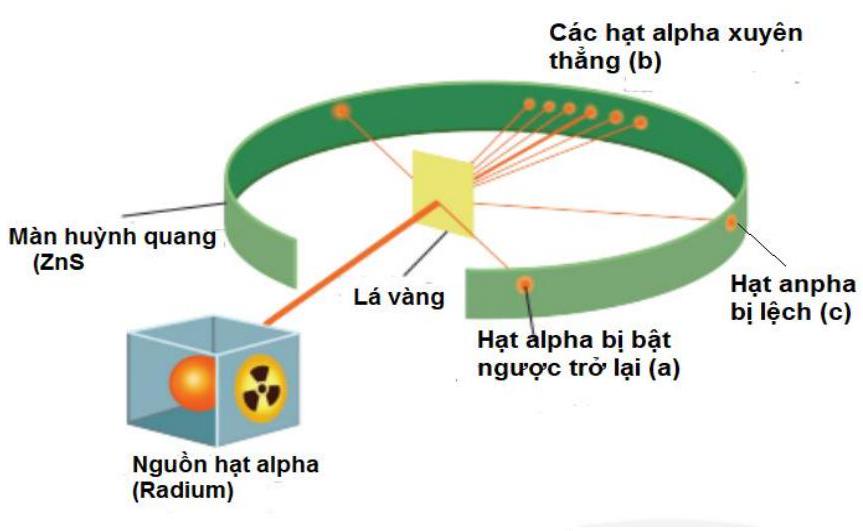 A. (a) và (b).
A. (a) và (b).
B. (b) và (c).
C. (a) và (c).
D. (a), (b) và (c).
Câu 14: Trong bảng tuần hoàn, nguyên tố $Y$ ở chu kì 2 và nhóm IA. Hydroxide cao nhất của $Y\left( {YOH} \right)$ có tính
A. kim loại mạnh.
B. phi kim mạnh.
C. base mạnh.
D. acid mạnh.
Câu 15: Quan sát mô hình bên. Xét về cấu trúc vỏ electron, các nguyên tử $N$ trong phân tử ${N_2}$ đã thỏa mãn quy tắc hay nguyên lý gì?
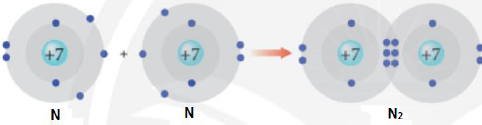
A. Nguyên lý vững bền.
C. Quy tắc Hund.
B. Quy tắc octet.
D. Nguyên lý Pauli.
II. TỰ LUẬN: (5,0 điểm)
Câu 1: (0,8 điểm)
Phổ khối của nguyên tố gallium (kí hiệu là Ga, $Z = 31$ ) được biểu diễn như hình bên. Biết $m/z$ có giá trị bằng nguyên tử khối.
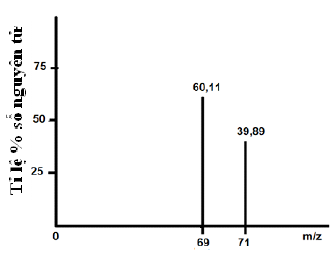
a. Viết kí hiệu nguyên tử (dạng $\;_Z^AX$ ) của các đồng vị gallium.
b. Tính nguyên tử khối trung bình của gallium. Kết quả phép tính được làm tròn đến 3 (ba) chữ số ở phần thập phân.
Câu 2: (1,8 điểm)
Cho hai nguyên tử $X\left( {Z = 9} \right)$ và $Y\left( {Z = 20} \right)$.
a. Viết cấu hình electron đầy đủ và xác định tính chất hóa học cơ bản của $X,Y$.
b. Dựa vào cấu hình electron và quy tắc octet, hãy cho biết các nguyên tử $X,Y$ có xu hướng nhường hay nhận bao nhiêu electron? Biểu diễn sự hình thành ion tương ứng của $X$, Y và sự tương tác giữa các ion đó để tạo thành hợp chất.
Câu 3: (1,6 điểm)
Trong hoạt động luyện tập cuối chương 2 – Bảng tuần hoàn các nguyên tố hóa học, giáo viên nêu nhiệm vụ sau đây để các nhóm học sinh thảo luận:
“Nguyên tử của nguyên tố X có lớp electron ngoài cùng là lớp M. Ở trạg thái co bản, nguyên tủ của $X$ không có electron độc thân. Hãy xác định vị trí (số thứ tụ ô nguyên tố, chu kì, nhóm) của X trong bảng tuần hoàn”.
Khi thảo luận nhóm, bạn A đã nêu ý kiến như sau: “Nếu không dùng bảng tuần hoàn các nguyên tố hóa học thì không thể xác định được vị trí của X”.
Em có đồng ý với ý kiến của bạn $A$ hay không? Vì sao? Hãy làm sáng tỏ khẳng định của em bằng cách thực hiện nhiệm vụ mà giáo viên đã nêu ở trên.
Câu 4: (0,8 điểm)
Tại sao muối ăn $\left( {NaCl} \right)$ tồn tại ở trạng thái rắn và cứng trong điều kiện thường, nhưng lại dễ vỡ khi bị một tác động nhẹ?
——HẾT—–
Lưu ý: Học sinh không được sử dụng tài liệu và Bảng tuần hoàn các nguyên tố hóa học.
ĐÁP ÁN
I. PHẦN TRẮC NGHIỆM
| 1 | B | 6 | D | 11 | B |
| 2 | D | 7 | D | 12 | A |
| 3 | C | 8 | C | 13 | C |
| 4 | A | 9 | B | 14 | C |
| 5 | A | 10 | D | 15 | B |
II. PHẦN TỰ LUẬN
Câu 1:
a. Kí hiệu nguyên tử
(1) $\;_{31}^{69}Ga;\;$ (2) $\;_{31}^{71}Ga$
b. ${\bar A_{Sb}} = \frac{{69.60,11 + 71.39,89}}{{100}} = 69,798$
Câu 2:
a.
+ Cấu hình electron:
(1) X: $1{s^2}2{s^2}2{p^5}$
(2) Y: $1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}4{s^2}$
+ Tính chất hóa học cơ bản:
(3) X có tính phi kim.
(4) Y có tính kim loại.
b.
(1) X nhận (thu) thêm 1 electron.
(2) Y nhường (cho) đi 2 electron.
+ Quá trình:
(1) $X + 1e \to {X^ – }$
(2) $Y \to {Y^{2 + }} + 2e$
+ Sự tương tác giữa các ion:
(3) Các ion ${X^ – }$và ${Y^{2 + }}$ hút nhau bằng lực hút tĩnh điện
tạo thành hợp chất.
(4) $2{X^ – } + {Y^{2 + }} \to Y{X_2}$ (hoặc $\left. {{X_2}Y} \right)$
Câu 3:
(1) Không đồng ý với ý kiến của bạn A.
(2) Vì có thể dựa vào cấu hình electron nguyên tử để suy ra vị trí của X trong bảng tuần hoàn.
Theo giả thiết, nguyên tử X có 3 lớp electron và không có electron độc thân nên phân lớp ngoài cùng có thể là $3{s^2}$hoặc $3{p^6}$. (HS có thể không trình bày ý này vẫn được).
(3) Cấu hình electron nguyên tử của X là 1 trong 2 cấu hình sau:
(4) $1{s^2}2{s^2}2{p^6}3{s^2}$
(5) X ở: ô số 12; (6) chu kì 3; (7) nhóm IIA.
(8) Vì nguyên tử có Z = E = 12, 3 lớp electron và 2 electron ở lớp ngoài cùng.
(9)$1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}$
(10) X ở: ô số 18; (11) chu kì 3; (12) nhóm VIIIA
(13) Vì nguyên tử có Z = E = 18, 3 lớp electron và 8 electron ở lớp ngoài cùng.
Câu 4:
+ Muối ăn $\left( {NaCl} \right)$ tồn tại ở trạng thái rắn và cứng trong
điều kiện thường vì:
(1) Muối ăn $\left( {NaCl} \right)$ có cấu trúc tinh thể;
(2) lực hút tĩnh điện giữa các ion là lực mạnh. (hoạc liên
kết ion là liên kết mạnh)
+ Khi bị tác động bởi một lực thì:
(3) một lớp ion bị khẽ dịch chuyển kéo theo toàn bộ
sự sắp xếp bị xáo trộn
(4) bởi các ion cùng dấu tự đẩy nhau
(5) khiến mạng tinh thể bị phá vỡ.