Đề kiểm tra cuối học kỳ 1 Hóa 11 Chân trời sáng tạo có đáp án-Đề 3 được soạn dưới dạng file word và PDF gồm 4 trang. Các bạn xem và tải về ở dưới.
I. PHẦN TRẮC NGHIỆM:
Câu 1. Dãy kim loại sau đây gồm những chất đều tác dụng được với dung dịch ${H_2}S{O_4}$ loãng là
A. $Ag,Fe,Ba,Sn$.
B. $Mg,Al,Fe,Zn$.
C. $Au,Pt,Al$.
D. $Cu,Zn,Na$.
Câu 2. Dãy các chất nào sau đây không có cùng công thức đơn giản nhất?
A. ${C_4}{H_4},{C_2}{H_2},{C_6}{H_6}$.
B. ${C_6}{H_{12}}{O_6},{C_4}{H_8}{O_2},{C_3}{H_6}O$.
C. ${C_2}{H_4}{O_2},{C_6}{H_{12}}{O_6},{C_3}{H_6}{O_3}$.
D. $C{H_2}O,{C_2}{H_4}{O_2},{C_4}{H_8}{O_4}$.
Câu 3. Sulfuric acid đặc, nguội có thể đựng trong bình chứa làm bằng
A. Al.
B. Ag.
C. $Ca$.
D. $Cu$.
Câu 4. Thành phần các nguyên tố trong hợp chất hữu cơ :
A. Gồm có $C,H$ và các nguyên tố khác.
B. Thường có $C,H$ hay gặp $O,N$ sau đó đến halogen, $S,P$.
C. Bao gồm tất cả các nguyên tố trong bảng tuần hoàn.
D. Nhất thiết phải có carbon, thường có $H$, hay gặp $O,N$ sau đó đến halogen, $S,P.$. .
Câu 5. Phương trình điện li nào dưới đây được viết đúng ?
A. ${H_2}S{O_3} \to {H^ + } + HSO_3^ – $.
B. $N{a_2}\;S$$\xrightarrow{{{t^0}}}$$2N{a^ + } + {S^{2 – }}$.
C. ${H_2}S{O_4}$ $\xrightarrow{{{t^0}}}$ ${H^ + } + HSO_4^ – $.
D. $HCl \to {H^ + } + C{l^ – }$.
Câu 6. Phương pháp phổ khối lượng (MS) dùng để
A. xác định thành phần nguyên tố của hợp chất hữu cơ.
B. xác định khối lượng phân tử các hợp chất hữu cơ.
C. Xác định khối lượng riêng của hợp chất hữu cơ.
D. xác định công thức cấu tạo các hợp chất hữu cơ.
Câu 7. Chất nào dưới đây không phân li ra ion khi hòa tan trong nước?
A. $MgC{l_2}$.
B. $HCl{O_3}$.
C. $Ba{(OH)_2}$.
D. ${C_6}{H_{12}}{O_6}$.
Câu 8. Hình dưới đây mô tả một số ứng dụng của chất $X$. Vậy chất $X$ là

Chất trung gian quan trọng trong quá trình sản xuất sulfuric acid.

Sử dụng để tẩy trắng bột giấy, khử màu trong sản xuất đường, chống nấm mốc

Dạng lỏng là một dung môi phân cực, được sử dụng để thực hiện nhiều phản ứng….
A. Sulfuric acid.
B. Sodium sulfate.
C. Sulfur.
D. Sulfur dioxide.
Câu 9. $X$ là nitrogen oxide, trong đó oxygen chiếm $36,36\% $ về khối lượng. Công thức của $X$ là
A. NO.
B. $N{O_2}$.
C. ${N_2}O$.
D. ${N_2}{O_5}$.
Câu 10. Đối với một hệ ở trạng thái cân bằng, nếu thêm chất xúc tác thì
A. Làm tăng tốc độ của phản ứng thuận và phản ứng nghịch như nhau.
B. Không làm tăng tốc độ phản ứng thuận và phản ứng nghịch.
C. Chỉ làm tăng tốc độ của phản ứng thuận.
D. Chỉ làm tăng tốc độ của phản ứng nghịch.
Câu 11. Trong các hợp chất hoá học sau hợp chất nào nitrogen có số oxi hóa thấp nhất ?
A. ${\left( {N{H_4}} \right)_2}S{O_4}$.
B. ${N_2}$.
C. $N{O_2}$.
D. $HN{O_2}$.
Câu 12. Khi tách và tinh chế chất lỏng dựa trên sự khác nhau về nhiệt độ sôi của các chất trong hỗn hợp ở áp suất nhất định, người ta thường sử dụng phương pháp nào sau đây ?
A. Kết tinh.
B. Sắc kí cột.
C. Chưng cất.
D. Chiết.
Câu 13. Acid nào sau đây là acid 2 nấc ?
A. $HCl$.
B. $HN{O_3}$.
C. ${H_2}S{O_3}$.
D. ${H_3}P{O_4}$.
Câu 14. Ammonia $\left( {N{H_3}} \right)$ tan nhiều trong nước do
A. $N{H_3}$ là phân tử không phân cực.
B. Phân tử $N{H_3}$ phân cực, có khả năng tạo liên kết hydrogen với nước.
C. $N{H_3}$ tồn tại ở trạng thái khí.
D. $N{H_3}$ nhẹ hơn không khí.
Câu 15. Ứng dụng nào sau đây không phải của nitrogen?
A. Tạo khí quyển trơ (giảm nguy cơ cháy nổ….).
B. Tổng hợp ammonia.
C. Tác nhân làm lạnh (bảo quản thực phẩm, mẫu vật sinh học…)
D. Sản xuất phân lân.
Câu 16. Công thức phân tử của chất có công thức cấu tạo đầy đủ như sau là ?
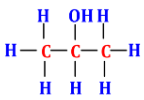
A. ${C_3}{H_8}{O_2}$.
B. ${C_3}{H_{10}}O$.
C. ${C_3}{H_6}O$.
D. ${C_3}{H_8}O$.
Câu 17. Saccharose là hợp chất hữu cơ có nhiều trong các cây mía nên thường được gọi là đường mía. Công thức phân tử của saccharose là ${C_{12}}{H_{22}}{O_{11}}$. Công thức đơn giản nhất của saccharose là
A. ${C_{12}}{H_{22}}{O_{11}}$.
B. ${C_3}{H_6}{O_3}$.
C. ${C_2}H{O_2}$.
D. ${C_6}{H_{11}}{O_{11}}$.
Câu 18. Cho sơ đồ chuyển hoá giữa nitrogen và hợp chất:
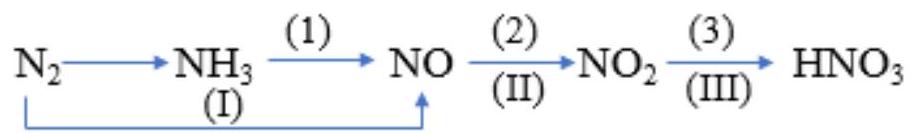
Phát biểu nào sau đây không đúng?
A. Nitrogen dioxide có thể trực tiếp tạo thành khi nitrogen phản ứng với oxygen dư.
B. Quá trình $\left( I \right) \to $ (II) $ \to $ (III) giải thích sự tạo thành nitric acid khi mưa dông kèm sấm chớp.
C. Các phản ứng trong sơ đồ đều là phản ứng oxi hoá – khử.
D. Quá trình $\left( 1 \right) \to \left( 2 \right) \to \left( 3 \right)$ dùng sản xuất nitric acid trong công nghiệp.
Câu 19. Phát biểu nào sau đây sai?
A. Trong phòng thí nghiệm, $S{O_2}$ được điều chế bằng cách đốt quặng pyrite.
B. $S{O_2}$ là chất trung gian để sản xuất sulfuric acid.
C. $S{O_2}$ dùng làm chất tẩy trắng giấy và bột giấy.
D. $S{O_2}$ dùng làm chất chống mốc lương thực, thực phẩm.
Câu 20. Bộ dụng cụ chiết (được mô tả như hình vẽ bên) dùng để
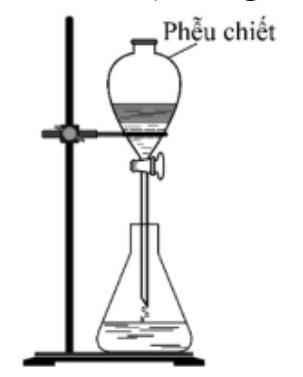
A. tách hai chất rắn tan trong dung dịch.
B. tách hai chất lỏng tan tốt vào nhau.
C. tách hai chất lỏng không tan vào nhau.
D. tách chất lỏng và chất rắn.
Câu 21. Trong các hợp chất sau: ${C_2}{H_2},C{H_3}COOH,A{l_4}{C_3},C{H_4},CC{l_4},Ca{C_2},C{O_2},C{H_3}Cl,{C_2}{H_5}OH$. Dãy gồm các chất hữu cơ là
A. ${C_2}{H_2},C{H_3}COOH,C{H_4},C{H_3}Cl,{C_2}{H_5}OH,Ca{C_2}$
B. ${C_2}{H_2},C{H_3}COOH,A{l_4}{C_3},C{H_4},C{H_3}Cl,{C_2}{H_5}OH$
C. ${C_2}{H_2},C{H_3}COOH,C{H_4},CC{l_4},C{H_3}Cl,{C_2}{H_5}OH$
D. ${C_2}{H_2},C{H_3}COOH,C{O_2},C{H_3}Cl,{C_2}{H_5}OH$
Câu 22. Cho các cân bằng sau :
(1) $2HI\left( g \right) \rightleftharpoons {H_2}\left( g \right) + {I_2}\left( g \right)$
(2) $CaC{O_3}\left( s \right)$ $ \rightleftharpoons $$CaO\left( s \right) + C{O_2}\left( g \right)$
(3) $FeO\left( s \right) + CO\left( g \right)$ $ \rightleftharpoons $$Fe\left( s \right) + C{O_2}\left( g \right)$
(4) $2S{O_2}\left( g \right) + {O_2}\left( g \right)$ $ \rightleftharpoons $ $2S{O_3}\left( g \right)$
Khi tăng áp suất của hệ, số cân bằng bị chuyển dịch theo chiều thuận là
A. 1 .
B. 2 .
C. 4 .
D. 3 .
Câu 23. Nhóm các chất nào sau đây tác dụng với dung dịch ${H_2}S{O_4}$ loãng chỉ xảy ra phản ứng trao đổi?
A. $Fe{(OH)_3},Mg,CuO,KHC{O_3}$.
B. $Fe,CuO,Cu{(OH)_2},BaC{l_2}$.
C. $FeO,Cu{(OH)_2},BaC{l_2},N{a_2}C{O_3}$.
D. $F{e_2}{O_3},Cu{(OH)_2},Zn,N{a_2}S{O_3}$.
Câu 24. Một bình kín chứa đầy chất khí $X$, đậy kín bình bằng nút cao su có ống dẫn (buộc trước một quả bóng bay vào đầu ống hút trong bình) như mô tả trong hình dưới đây.
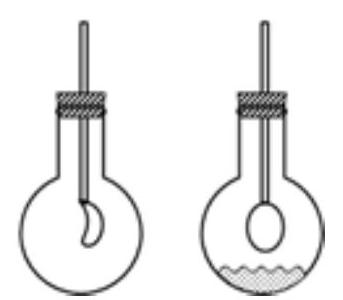
Mở nút cao su, cho nhanh chất lỏng $Y$ vào, đậy nút ngay lập tức, quan sát thấy quả bóng dần được thổi căng lên. Chất $X$ và $Y$ phù hợp với thí nghiệm là
A. ${N_2}$ và $NaOH$.
B. $N{H_3}$ và ${H_2}S{O_4}$.
C. ${H_2}$ và nước.
D. $C{O_2}$ và $HCl$.
Câu 25. Phát biểu nào sau đây sai về sulfur?
A. Điều kiện thường là chất rắn, màu vàng, không tan trong nước.
B. Tồn tại trong tự nhiên ở dạng đơn chất và hợp chất.
C. Chỉ thể hiện tính oxi hóa trong các phản ứng hóa học.
D. Sulfur có hai dạng thù hình là dạng đơn tà và dạng tà phương.
Câu 26. Dựa vào phổ hồng ngoại (IR) của hợp chất $X$ có công thức $C{H_3}COC{H_3}$ dưới đây, hãy chỉ ra peak nào giúp dự đoán $X$ có nhóm $C = O$ ?
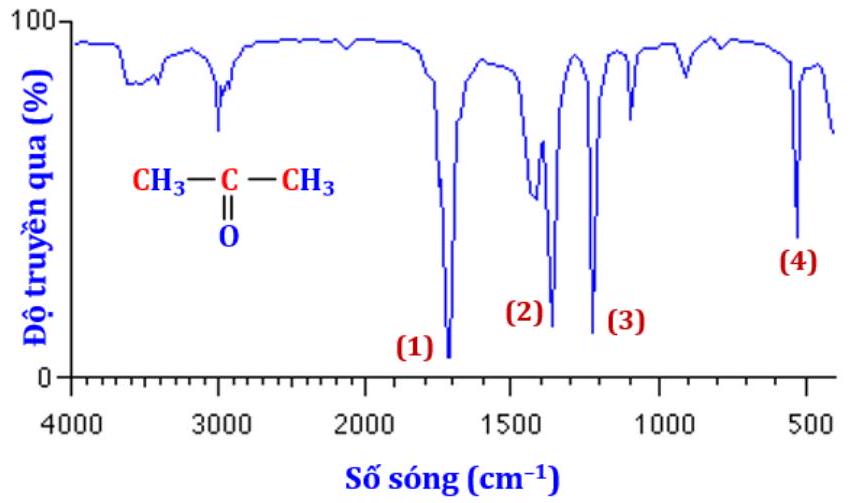
A. (4).
B. (1).
C. (2).
D. (3).
Câu 27. Theo thuyết cấu tạo hóa học, chất nào sau đây là đúng về hóa trị của carbon?
A. $HO – C{H_3} – CH = O$.
B. $C{H_3} – CH = C{H_2} – C{H_3}$.
C. $CH \equiv CH – C{H_2} – C{H_3}$.
D. $C{H_3} – C{H_2} – C{H_2} – CH{\left( {C{H_3}} \right)_2}$.
Câu 28. Cho sơ đồ chuyển hoá giữa nitrogen và hợp chất như sau (mỗi mũi tên là một phản ứng):
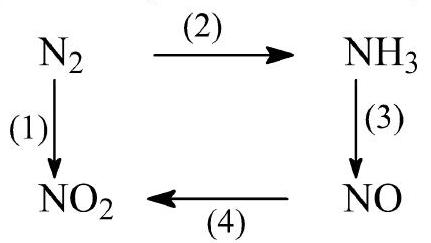
Phản ứng không thể thực hiện được trong sơ đồ trên là
A. (4).
B. (1).
C. (2).
D. (3).
II. PHẦN TỰ LUẬN:
Câu 1.
Có 2 ý kiến của học sinh như sau:
Học sinh (1): Sau một thời gian bón phân đạm ammonium $\left( {N{H_4}Cl,N{H_4}N{O_3}, \ldots } \right)$ thì độ chua của đất tăng
lên vì ion $NH_4^ + $thủy phân tạo môi trường acid làm cho đất chua”.
Học sinh (2): Bón phân đạm ammonium thì độ chua của đất giảm vì $NH_4^ + $thủy phân tạo môi trường base”. Theo em, ý kiến của bạn nào đúng? Tại sao?
Câu 2.
Hỗn hợp $X$ gồm $S{O_2}$ và ${O_2}$ có tỉ khối so với ${H_2}$ bằng 28. Lấy 4,958 lít hỗn hợp $X$ (đkc) cho đi qua bình đựng ${V_2}{O_5}$ nung nóng. Hỗn hợp thu được cho lội qua dung dịch $Ba{(OH)_2}$ dư thấy có 33,51 gam kết tủa. Tính hiệu suất phản ứng oxi hóa $S{O_2}$ thành $S{O_3}$.
Câu 3.
Khói thuốc lá làm tăng khả năng bị ung thư phổi, hoạt chất có độc trong thuốc lá là nicotine. Kết quả phân tích nguyên tố của nicotine cho thành phần phần trăm khối lượng như sau: $74,07\% C,8,65\% H,17,28\% \;N$. Phân tử khối của nicotine được xác định thông qua phổ khối lượng, peak ion $\left[ {{M^ + }} \right]$có giá trị $m/z$ lớn nhất bằng 162. Xác định công thức phân tử của nicotine.

HƯỚNG DẪN GIẢI
I. PHẦN TRẮC NGHIỆM
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| B | B | A | D | D | B | D |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| D | C | A | A | C | C | B |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| D | D | A | A | A | C | C |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| A | C | B | C | B | D | B |
II. PHẦN TỰ LUẬN
Câu 1.
Ý kiến của học sinh (1) đúng. Vì trong phân đạm ammonium có ion
$N{H^ + }{\;^ + }$thủy phân sinh ra ${H^ + }{O^ + }$tạo môi trường acid nên làm cho đất chua.
PTHH: $N{H_4}^ + + {H_2}O \to N{H_3} + {H_3}{O^ + }$
Câu 2.

Áp dụng sơ đồ đường chéo, ta có:
$\frac{{{n_{S{O_2}}}}}{{{n_{{O_2}}}}} = \frac{{56 – 32}}{{64 – 56}} = \frac{3}{1}$ và ${n_{S{O_2} + }}{n_{{O_2}}} = 0,2$
$ \Rightarrow {n_{S{O_2}}} = 0,15\;mol;\;{n_{{O_2}}} = 0,05\;mol$.
Gọi $mol\,S{O_3}$ là $x$ mol. Theo đề bài, ta có:
${m_{kettua\;}} = {m_{BasO{\;_4}}} + {m_{BasO{\;_3}}} = 233 \cdot x + 217 \cdot \left( {0,15 – x} \right) = 33,51$.
$ \Rightarrow x = 0,06\;mol \Rightarrow {n_{{O_2}pu}} = 0,03\;mol$.
Vậy $H = \frac{{0,03}}{{0,05}} \cdot 100\% = 60\% $
Câu 3.
Gọi công thức tổng quát của nicotine là ${C_X}{H_y}{N_Z}$
Ta có: $x:y:z = \frac{{74,07}}{{12}}:\frac{{8,65}}{1}:\frac{{17,28}}{{14}}$
$ = 6,17:8,65:1,23 = 5:7:1$
$ \Rightarrow $ của nicotine là ${C_5}{H_7}\;N$
Công thức phân tử của nicotine có dạng: ${\left( {{C_5}{H_7}\;N} \right)_n}$
${M_{nicotine\;}} = 81n = 162 \Rightarrow n = 2 \Rightarrow CTPT$ của nicotine là ${C_{10}}{H_{14}}\;{N_2}$