Trắc nghiệm Xác định pH của dung dịch Hóa 11 có lời giải được soạn dưới dạng file word gồm 12 trang. Các bạn xem và tải về ở dưới.
TRẮC NGHIỆM VỀ XÁC ĐỊNH pH
I. LÝ THUYẾT CƠ BẢN
1. Xác định pH dung dịch
• Tính số ${\text{mol}}{{\text{H}}^ + }/{\text{O}}{{\text{H}}^ – }$ hoặc tổng số ${\text{mol}}{{\text{H}}^ + }/{\text{O}}{{\text{H}}^ – }$
• Tính nồng độ ${{\text{H}}^ + }/{\text{O}}{{\text{H}}^ – }$
• Áp dụng công thức tính ${\text{pH}}:{\text{pH}} = – {\text{lg}}\left[ {{{\text{H}}^ + }} \right]$
• Nếu là dung dịch base ta tính nồng độ ${\text{O}}{{\text{H}}^ – } \to {\text{pOH}} \to {\text{pH}} = 14 – {\text{pOH}}$
2. Phối trộn, pha loãng dung dịch
• Tính số mol acid, base
• Viết phương trình điện li
• Tính tổng số ${\text{mol}}{{\text{H}}^ + },{\text{O}}{{\text{H}}^ – }$
• Viết phương trình phản ứng trung hòa
• Xác định môi trường của dung dịch dựa vào ${\text{pH}} \to $ Xem xét mol aicd hay base dư
$ \to $ Tìm các giá trị mà bài toán yêu cầu.
Chú ý:
${{\text{V}}_{{\text{ddsaukhitron}}}} = {{\text{V}}_{{\text{acid}}}} + {{\text{V}}_{{\text{base}}}}$
3. Công thức tính gần đúng pH của acid và base yếu
• Công thức tính ${\text{pH}}$ gần đúng của một dung dịch acid yếu là:
${\text{pH}} = 1/2\left( {{\text{p}}{{\text{K}}_{\text{a}}} – {\text{lg}}{{\text{C}}_{\text{M}}}} \right)$
Trong đó: ${{\text{K}}_{\text{a}}}$ và ${{\text{C}}_{\text{M}}}$ là hằng số phân li acid và nồng độ acid.
-Công thức tính ${\text{pH}}$ gần đúng của một dung dịch base yếu là:
${\text{pOH}} = 1/2\left( {{\text{p}}{{\text{K}}_{\text{b}}} – {\text{lg}}{{\text{C}}_{\text{M}}}} \right) \to {\text{pH}} = 14 – {\text{pOH}}$
Trong đó: ${{\text{K}}_{\text{b}}}$ và ${{\text{C}}_{\text{M}}}$ là hằng số phân li base và nồng độ base.
Chú ý $p{K_a} = – \lg {K_a};\,p{K_b} = – \lg {K_b}$
II. VÍ DỤ MINH HỌA
Câu 1. Trộn $10{\text{g}}$ dung dịch ${\text{HCl}}7,3{\text{% }}$ với $20{\text{g}}$ dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}4,9{\text{% }}$ rồi thêm nước để được $100{\text{ml}}$ dung dịch ${\text{A}}$. Tính ${\text{pH}}$ của dung dịch ${\text{A}}$.
Lời giải
Số mol HCl là ${{\text{n}}_{{\text{HCl}}}} = \left( {10.7,3} \right)/\left( {100.36,5} \right) = 0,02{\text{mol}}$
Số ${\text{mol}}{{\text{H}}_2}{\text{S}}{{\text{O}}_4}$ là ${{\text{n}}_{{\text{H}}2}}{\text{S}}{{\text{O}}_4} = \left( {20.4,9} \right)/\left( {100.98} \right) = 0,01{\text{mol}}$
Phương trình điện ly: ${\text{HCl}} \to {{\text{H}}^ + } + {\text{C}}{{\text{l}}^ – }$
$\begin{array}{*{20}{r}}
{}&{0,02 \to 0,02{\text{mol}}} \\
{}&{{{\text{H}}_2}{\text{S}}{{\text{O}}_4} \to 2{{\text{H}}^ + } + {\text{S}}{{\text{O}}_4}{^{2 – }}} \\
{}&{0,01 \to 0,02{\text{mol}}}
\end{array}$
Tổng số ${\text{mol}}{{\text{H}}^ + }$là ${{\text{n}}_{\text{H}}}{^ + } = 0,02 + 0,02 = 0,04{\text{mol}}$
$\left[ {{{\text{H}}^ + }} \right] = 0,04/0,1 = 0,4{\text{M}} \to {\text{pH}} = 0,4$.
Câu 2. Hoà tan 3,66 gam hỗn hợp ${\text{Na}},{\text{Ba}}$ vào nước dư thu được $800{\text{ml}}$ dung dịch ${\text{A}}$ và 0,896 lít ${{\text{H}}_2}$ (đktc). Tính ${\text{pH}}$ của dung dịch ${\text{A}}$
Lời giải
${{\text{n}}_{{\text{H}}2}} = 0,896/22,4 = 0,04{\text{mol}}$
Gọi số mol của ${\text{Na}}$ và ${\text{Ba}}$ lần lượt là ${\text{x}},{\text{y}}$ mol.
Ta có: $23x + 137y = 3,66$
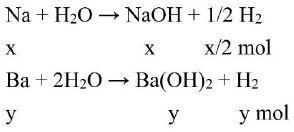
$ \to {\text{x}}/2 + {\text{y}} = 0,04$
Từ $\left( 1 \right),\left( 2 \right)$ ta có: ${\text{x}} = 0,04$ và ${\text{y}} = 0,02$
Phương trình điện ly:
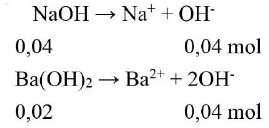
Tổng số ${\text{molO}}{{\text{H}}^ – }$là: ${\text{nO}}{{\text{H}}^ – } = 0,08{\text{mol}}$
$\left[ {{\text{O}}{{\text{H}}^ – }} \right] = 0,08/0,8 = 0,1{\text{M}} \to {\text{pOH}} = 1 \to {\text{pH}} = 13$
Câu 3. Hoà tan 1,07g ${\text{N}}{{\text{H}}_4}{\text{Cl}}$ vào nước được 2 lít dung dịch ${\text{X}}$.
a. Tính ${\text{pH}}$ của dung dịch ${\text{X}}$ biết hằng số phân li base của ${\text{N}}{{\text{H}}_3}$ là $1,8 \cdot {10^{ – 5}}$.
b. Nếu thêm vào dung dịch ${\text{X}}100{\text{ml}}$ dd ${\text{HCl}}$ 0,01 ${\text{M}}$ được dung dịch ${\text{Y}}$. Tính ${\text{pH}}$ của dung dịch Y?
Lời giải
a. ${{\text{n}}_{{\text{NH}}4{\text{Cl}}}} = 1,07/53,5 = 0,02 \to \left[ {{\text{N}}{{\text{H}}_4}{\text{Cl}}} \right] = 0,02/2 = 0,01{\text{M}}$
Phương trình điện ly:
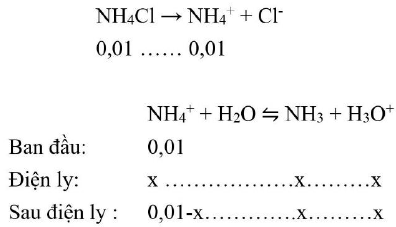
${{\text{K}}_{\text{b}}} = {{\text{x}}^2}/\left( {0,01 – {\text{x}}} \right) = 1,8 \cdot {10^{ – 5}} \to {\text{x}} = 4,24 \cdot {10^{ – 4}} \to {\text{pH}} = 3,37$
b. Phương trình điện ly:
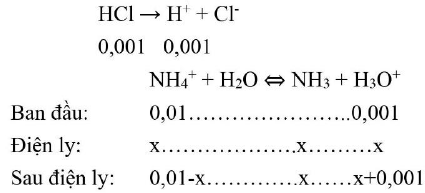
${{\text{K}}_{\text{b}}} = {\text{x}}\left( {{\text{x}} + 0,001} \right)/\left( {0,01 – {\text{x}}} \right) = 1,8 \cdot {10^{ – 5}} \to {\text{x}} = 3,69 \cdot 10 – 4 \to {\text{pH}} = 3,43$.
Câu 4. Trộn 3 dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}0,1{\text{M}};{\text{HN}}{{\text{O}}_3}0,2{\text{M}};{\text{HCl}}0,3{\text{M}}$ với thể tích bằng nhau thu được dung dịch ${\text{A}}$. Lấy $300{\text{ml}}$ dung dịch ${\text{A}}$ tác dụng với dung dịch ${\text{B}}$ gồm ${\text{NaOH}}0,2{\text{M}}$ và ${\text{Ba}}{({\text{OH}})_2}0,1{\text{M}}$. Tính thể tích dung dịch ${\text{B}}$ cần dùng để sau khi phản ứng kết thúc thu được dung dịch có ${\text{pH}} = 1$. ${\text{CoiBa}}{({\text{OH}})_2}$ và ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$ phân li hoàn toàn ở 2 nấc.
Lời giải
Sau khi trộn 3 dung dịch acid có thể tích bằng nhau ta thu được nồng độ mới của 3 acid là: $\left[ {{\text{HCl}}} \right] = 0,1{\text{M}};\left[ {{\text{HN}}{{\text{O}}_3}} \right] = 0,2/3;\left[ {{{\text{H}}_2}{\text{S}}{{\text{O}}_4}} \right] = 0,1/3$.
Trong $300{\text{ml}}$ dung dịch ${\text{A}}:{{\text{n}}_{{\text{HCl}}}} = 0,03{\text{mol}};{{\text{n}}_{{\text{H}}2}}{\text{S}}{{\text{O}}_4} = 0,01{\text{mol}};{{\text{n}}_{{\text{HNO}}3}} = 0,02{\text{mol}}$ Phương trình điện ly:
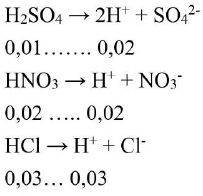
Tổng ${\text{mol}}{{\text{H}}^ + }$là ${{\text{n}}_{\text{H}}}{^ + } = 0,07{\text{mol}}$
Gọi $x$ là thể tích của dung dịch $B$ cần dùng. Khi đó ta có: ${{\text{n}}_{{\text{NaOH}}}} = 0,2{\text{x}};{{\text{n}}_{{\text{Ba}}\left( {{\text{OH}}} \right)2}} = 0,1{\text{x}}$
Phương trình điện ly:
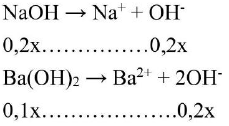
Tổng số ${\text{molO}}{{\text{H}}^ – }$là: ${\text{nO}}{{\text{H}}^ – } = 0,4{\text{x}}$
Ta có: ${\text{}}{{\text{H}}^ + } + {\text{O}}{{\text{H}}^ – } \to {{\text{H}}_2}{\text{O}}$ (Sau phản ứng ${\text{pH}} = 1 \to $ dư acid)

$\left( {0,07 – 0,4x} \right)/\left( {x + 0,3} \right) = 0,1 \to x = 0,08$ lít
III. BÀI TẬP TRẮC NGHIỆM
Câu 1. Dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}0,10{\text{M}}$ có
A. ${\text{pH}} = 1$
B. ${\text{pH}} < 1$
C. $\left[ {{{\text{H}}^ + }} \right] > 2,0{\text{M}}$
D. ${\text{pH}} > 1$
Câu 2. Trộn $200{\text{ml}}$ dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$ 0,05M với 300ml dung dịch ${\text{HCl}}0,1{\text{M}}$ thu được dung dịch Y. pH của dung dịch ${\text{Y}}$ là:
A. 1,3
B. 4
C. 1
D. 3
Câu 3. Dung dịch ${\text{NaOH}}0,01{\text{M}}$ có giá trị ${\text{pH}}$ là
A. 2
B. 1
C. 13
D. 12
Câu 4. Dung dịch ${\text{X}}$ có ${\text{pH}} = 12$, thì $\left[ {{\text{O}}{{\text{H}}^ – }} \right]$của dung dịch là
A. $0,01{\text{M}}$
B. $1,2{\text{M}}$
C. $0,12{\text{M}}$
D. $0,20{\text{M}}$
Câu 5. Pha loãng dung dịch ${\text{HCl}}$ có ${\text{pH}} = 2$ bao nhiêu lần để được dung dịch có ${\text{pH}} = 3$ ?
A. 5 .
B. 100 .
C. 20 .
D. 10 .
Câu 6. Phải thêm bao nhiêu ${\text{ml}}$ nước vào $10{\text{ml}}$ dung dịch ${\text{NaOHpH}} = 12$ để được 1 dung dịch có ${\text{pH}} = 11$ ?
A. $90{\text{ml}}$
B. $10{\text{ml}}$
C. $20{\text{ml}}$
D. $50{\text{ml}}$
Câu 7. Trộn $300{\text{ml}}$ dung dịch ${\text{HCl}}0,05{\text{M}}$ với $200{\text{ml}}$ dung dịch ${\text{Ba}}{({\text{OH}})_2}{\text{aM}}$ thu được $500{\text{ml}}$ dung dịch có ${\text{pH}} = 12$. Giá trị của a là
A. 0,025
B. 0,05
C. 0,1
D. 0,5
Câu 8. ${\text{Z}}$ là dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}1{\text{M}}$. Để thu được dung dịch ${\text{X}}$ có ${\text{pH}} = 1$ cần phải thêm vào 1 lít dd ${\text{Z}}$ thể tích dung dịch ${\text{NaOH}}1,8{\text{M}}$ là
A. 1 lít.
B. 1,5 lít.
C. 3 lít.
D. 0,5 lít.
Câu 9. Trộn lẫn 3 dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}0,1{\text{M}};{\text{HN}}{{\text{O}}_3}0,2{\text{M}}$ và ${\text{HCl}}0,3{\text{M}}$ với những thể tích bằng nhau thu được dung dịch ${\text{A}}$. Tính ${\text{pH}}$ của dung dịch ${\text{A}}$ ?
A. 0,632 .
B. 0,362 .
C. 0,263.
D. 0,623 .
Câu 10. Trộn $100{\text{ml}}$ dung dịch ${\text{NaOH}}0,02{\text{M}}$ với 200ml dung dịch ${\text{KOH}}0,05{\text{M}}$ thu được dung dịch ${\text{X}}.{\text{pH}}$ của dung dịch ${\text{X}}$ là:
A. 1,40 .
B. 12,60 .
C. 2,67.
D. 11,33 .
Câu 11. Trộn lẫn $50{\text{ml}}$ dung dịch ${\text{Ba}}{({\text{OH}})_2}0,05{\text{M}}$ với $150{\text{ml}}$ dung dịch ${\text{HCl}}0,02{\text{M}}$ thu được dung dịch có ${\text{pH}}$ là:
A. 1
B. 12
C. 13
D. 2
Câu 12. Dung dịch ${\text{X}}$ gồm ${\text{Ba}}{({\text{OH}})_2}1{\text{M}}$ và ${\text{NaOH}}1{\text{M}}$; dung dịch ${\text{Y}}$ gồm ${\text{HCl}}0,125{\text{M}}$ và ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$ 0,375M. Trộn $10{\text{ml}}$ dung dịch ${\text{X}}$ với $40{\text{ml}}$ dung dịch ${\text{Y}}$, được dung dịch ${\text{Z}}$. Giá trị ${\text{pH}}$ của ${\text{Z}}$ là:
A. 1 .
B. 12 .
C. 2 .
D. 13 .
Câu 13. ${\text{pH}}$ của dung dịch ${\text{HCl}}{10^{ – 7}}{\text{M}}$ là:
A. 7,00
B. 6,50
C. 6,79
D. 6,86
Câu 14. ${\text{pH}}$ của dung dịch ${\text{NaOH}}0,001{\text{M}}$ là
A. 3
B. 4
C. 11
D. 10
Câu 15. Tính ${\text{pH}}$ của $500{\text{ml}}$ dung dịch ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$, biết rằng để trung hòa lượng acid trên cần vừa đủ $0,005{\text{molNaOH}}$ ?
A. 1
B. 2
C. 3
D. 4
Câu 16. Dung dịch ${\text{Ba}}{({\text{OH}})_2}0,01{\text{M}}$ có ${\text{pH}}$ bằng
A. ${\text{pH}} = 12,3$
B. ${\text{pH}} = 10$
C. ${\text{pH}} = 7$
D. ${\text{pH}} = 11$
Câu 17. Tính ${\text{pH}}$ của dung dịch ${\text{C}}{{\text{H}}_3}{\text{COOH}}0,1{\text{M}}$ biết ${{\text{K}}_{\text{a}}} = 1,8 \cdot {10^{ – 5}}$ ?
A. 1,00
B. 2,87
C. 6,05
D. 6,04
Câu 18. Tính ${\text{pH}}$ của dung dịch ${\text{N}}{{\text{H}}_3}0,1{\text{M}}$ biết ${{\text{K}}_{\text{b}}} = 1,8 \cdot {10^{ – 5}}$ ?
A. 2,876
B. 2,567
C. 11,124
D. 11,433
Câu 19. Tính ${\text{pH}}$ của dung dịch ${\text{HCOOH}}0,1{\text{M}}$ biết ${{\text{K}}_{\text{a}}} = 1,{6.10^{ – 4}}$ ?
A. 2,398
B. 3,973
C. 3,698
D. 2,673
Câu 20. Tính ${\text{pH}}$ của $200{\text{ml}}$ dung dịch ${\text{Ba}}{({\text{OH}})_2}$ biết để trung hòa dung dịch trên cần 0,02 mol HCl?
A. 12
B. 13
C. 11
D. 10
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 |
|
B |
C | D | A | D |
| 6 | 7 | 8 | 9 |
10 |
|
A |
B | A | A | B |
| 11 | 12 | 13 | 14 |
15 |
|
B |
A | C | C | B |
| 16 | 17 | 18 | 19 |
20 |
| A | B | C | A |
B |
Câu 1.
Lời giải
$\begin{array}{*{20}{r}}
{}&{\left[ {{{\text{H}}^ + }} \right] = 0,1 \cdot 2 = 0,2{\text{M}}} \\
{}&{ \to {\text{pH}} = – {\text{log}}\left[ {{{\text{H}}^ + }} \right]} \\
{}&{ \to {\text{pH}}0,7 < 1}
\end{array}$
Chọn B.
Câu 2.
Lời giải:
$\sum {{\text{n}}_{{\text{H}} + }} = 2 \cdot {{\text{n}}_{{\text{H}}2{\text{SO}}4}} + {{\text{n}}_{{\text{HCl}}}} = 2 \cdot 0,2 \cdot 0,05 + 0,3 \cdot 0,1 = 0,05{\text{M}}$
Thể tích dung dịch sau khi trộn bằng $200 + 300 = 500{\text{ml}}$
$ \to \left[ {{{\text{H}}^ + }} \right] = = 0,1{\text{M}}$
$ \to {\text{pH}} = – {\text{log}}\left[ {{{\text{H}}^ + }} \right] = 1$
Chọn C. $ \to {\text{nO}}{{\text{H}}_{{\text{Odu}}}} = {10^{ – 2}} \cdot 0,5 = 0,005{\text{mol}}$
${\text{n}}{{\text{O}}_{{\text{H}} – {\text{pu}}}} = {{\text{n}}_{{\text{H}} + {\text{pu}}}} = 0,015{\text{mol}}$
nOH-dư $ = $ nOH-ban đầu $ – {{\text{n}}_{{\text{OH}} – {\text{phanung}}}}$
$ \to 0,005 = 0,4{\text{a}} – 0,015 \to {\text{a}} = 0,05{\text{M}}$
Chọn B.
Câu 8.
Lời giải:
Gọi ${\text{V}}$ (lít) là thể tích dung dịch ${\text{NaOH}}$ cần thêm
$ \to {{\text{V}}_{{\text{ddX}}}} = 1 + {\text{V}}$ (lít)
${{\text{n}}_{{\text{NaOH}}}} = 1,8{\text{V}} = {{\text{n}}_{{\text{H}} + {\text{phanung}}}}$
${\text{pH}} = 1 \to $ dung dịch ${\text{X}}$ có môi trường acid $ \to $ acid dư $ \to \left[ {{{\text{H}}^ + }} \right]{\text{du}} = 0,1{\text{M}}$
$ \to {{\text{n}}_{{\text{H}} + {\text{du}}}} = 0,1.\left( {1 + {\text{V}}} \right)$
$ \to 2 = 1,8{\text{V}} + 0,1.\left( {1 + {\text{V}}} \right) \to {\text{V}} = 1$ lít
Chọn A.
Câu 9.
Lời giải:
Gọi V (lít) là thể tích của mỗi dung dịch
$\sum {{\text{n}}_{{{\text{H}}^ + }}} = {{\text{n}}_{{\text{HCl}}}} + 2{{\text{n}}_{{\text{H}}2{\text{SO}}4}} + {{\text{n}}_{{\text{HNO}}3}} = 0,3{\text{V}} + 2.0,1{\text{V}} + 0,2{\text{V}} = 0,7{\text{V}}$ mol
$ \to \left[ {{\text{H}} + } \right] = 0,7{\text{V}}/3{\text{V}} = 7/30 \to {\text{pH}} = – {\text{log}}\left[ {{{\text{H}}^ + }} \right] = 0,632$
Chọn A.
Câu 10.
Lời giải:
${{\text{n}}_{{\text{OH}} – }} = {{\text{n}}_{{\text{NaOH}}}} + {{\text{n}}_{{\text{KOH}}}} = 0,1 \cdot 0,02 + 0,2 \cdot 0,05 = 0,012{\text{mol}}$
${{\text{V}}_{{\text{ddX}}}} = 100 + 200 = 300{\text{ml}} = 0,3$ (lít)
$ \to \left[ {{\text{O}}{{\text{H}}^ – }} \right] = 0,012/0,3 = 0,04{\text{M}} \to {\text{pOH}} = – {\text{log}}\left( {0,04} \right) = 1,40 \to {\text{pH}} = 14 – 1,40 = 12,6$.
Chọn B.
Câu 11.
Lời giải:
${\text{nO}}{{\text{H}}^ – } = 2{{\text{n}}_{{\text{Ba}}\left( {{\text{OH}}} \right)2}} = 2 \cdot 0,05 \cdot 0,05 = 0,005{\text{mol}}$
${{\text{n}}_{{\text{H}} + }} = {{\text{n}}_{{\text{HCl}}}} = 0,15 \cdot 0,02 = 0,003{\text{mol}}$
$ \to {\text{O}}{{\text{H}}^ – }{\text{du}}$
${{\text{n}}_{{\text{OH}} – {\text{pu}}}} = {{\text{n}}_{{\text{H}} + {\text{pu}}}} = 0,003{\text{mol}}$
$ \to {{\text{n}}_{{\text{OH}} – {\text{du}}}} = 0,002{\text{mol}} \to \left[ {{\text{O}}{{\text{H}}^ – }} \right]{\text{du}} = 0,002/0,2 = 0,01{\text{M}}$
$ \to {\text{pOH}} = – {\text{log}}\left[ {{\text{O}}{{\text{H}}^ – }} \right] = 2 \to {\text{pH}} = 14 – 2 = 12$
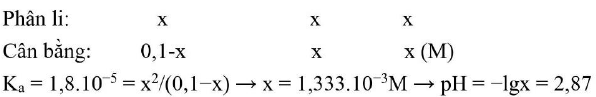
Chọn B.
Câu 18.
Lời giải:
Áp dụng công thức tính gần đúng ta có:
${\text{pOH}} = 1/2\left( {{\text{p}}{{\text{K}}_{\text{b}}} – {\text{lg}}{{\text{C}}_{\text{M}}}} \right) = 1/2\left[ { – {\text{lg}}\left( {1,8 \cdot {{10}^{ – 5}}} \right) – {\text{lg}}0,1} \right] \to {\text{pH}} = 14 – {\text{pOH}} = 11,124$.
Chọn C.
Câu 19.
Lời giải:
Áp dụng công thức tính gần đúng ta có:
${\text{pH}} = 1/2\left( {{\text{p}}{{\text{K}}_{\text{a}}} – {\text{lg}}{{\text{C}}_{\text{M}}}} \right) = 1/2\left[ { – {\text{lg}}\left( {1,{{6.10}^{ – 4}}} \right) – {\text{lg}}0,1} \right] = 2,398$
Chọn A.
Câu 20.
Lời giải:
Phương trình :
${\text{Ba}}{({\text{OH}})_2} \to {\text{B}}{{\text{a}}^{2 + }} + 2{\text{O}}{{\text{H}}^ – }$
${\text{HCl}} \to {{\text{H}}^ + } + {\text{C}}{{\text{l}}^ – }$
${\text{O}}{{\text{H}}^ – } + {{\text{H}}^ + } \to {{\text{H}}_2}{\text{O}}$
Ta có :
${{\text{n}}_{{\text{O}}{{\text{H}}^ – }}} = {{\text{n}}_{{{\text{H}}^ + }}} = 0,02{\text{mol}} \to \left[ {{\text{O}}{{\text{H}}^ – }} \right] = 0,02/0,2 = 0,1{\text{M}} \to {\text{pH}} = 14 + {\text{lg}}\left[ {{\text{O}}{{\text{H}}^ – }} \right] = 13$
Chọn B.