Trắc nghiệm lý thuyết về Ph dung dịch-chuẩn độ acid-base Hóa 11 có lời giải được soạn dưới dạng file word gồm 10 trang. Các bạn xem và tải về ở dưới.
Trắc Nghiệm Lý Thuyết Về Ph Dung Dịch-Chuẩn Độ Acid-Base
I. LÝ THUYẾT CƠ BẢN
1. pH dung dịch
pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch. pH liên hệ trực tiếp với nồng độ ${{\text{H}}^ + }$thông qua biểu thức sau:
• Biểu thức trung gian: $\left[ {{{\text{H}}^ + }} \right] = {10^{ – {\text{pH}}}}$.
${\text{pH}} = – {\text{lg}}\left[ {{{\text{H}}^ + }} \right]$
• Trong dung dịch nước của bất kỳ chất nào ở ${25^ \circ }{\text{C}}$ luôn có tích số $\left[ {{{\text{H}}^ + }} \right]\left[ {{\text{O}}{{\text{H}}^ – }} \right] = {10^{ – 14}}$.
• So với mốc là 7 , dung dịch có ${\text{pH}}$ càng nhỏ hơn 7 có tính acid càng mạnh, giá trị ${\text{pH}}$ càng lớn hơn 7, dung dịch có tính base càng lớn.
Nhiều quá trình hóa học trong tự nhiên, trong sản xuất và trong cơ thể sống xảy ra trong dung dịch nước với sự có mặt của các acid, base.

Một số chất như methyl da cam, phenolphthalein, quỳ tím,…thay đổi màu sắc khác nhau trong các môi trường acid và base, gọi là chất chỉ thị acid – base.
Chuẩn độ acid – base
Chuẩn độ là phương pháp dùng để xác định nồng độ của một chất trong dung dịch bằng một dung dịch khác đã biết nồng độ.
II. BÀI TẬP MINH HỌA
Câu 1. Cẩm tú cầu là loài có hoa thay đồi màu sắc theo ${\text{pH}}$ thổ nhưỡng như sau:
• ${\text{pH}} = 7$, hoa có màu trắng sữa.
• ${\text{pH}} < 7$, hoa có màu lam.
• ${\text{pH > }}7$ , hoa có màu hồng.
Muốn cẩm tú cầu có hoa màu hồng, ta phải làm gì?

Lời giải
Muốn cẩm tú cầu cho hoa màu hồng, có thể bón vôi dưới gốc cây hoa. Vôi khi gặp nước sẽ tạo thành ${\text{Ca}}{({\text{OH}})_2}$ có tính kiềm, tạo môi trường thổ nhưỡng ${\text{pH}}$ cao giúp cây ra hoa có màu hồng.
Câu 2. Khi chuẩn độ dung dịch ${\text{NaOH}}$ chưa biết nồng độ bằng dung dịch ${\text{HCl}}$, ta sẽ thiết kế thí nghiệm như sau:
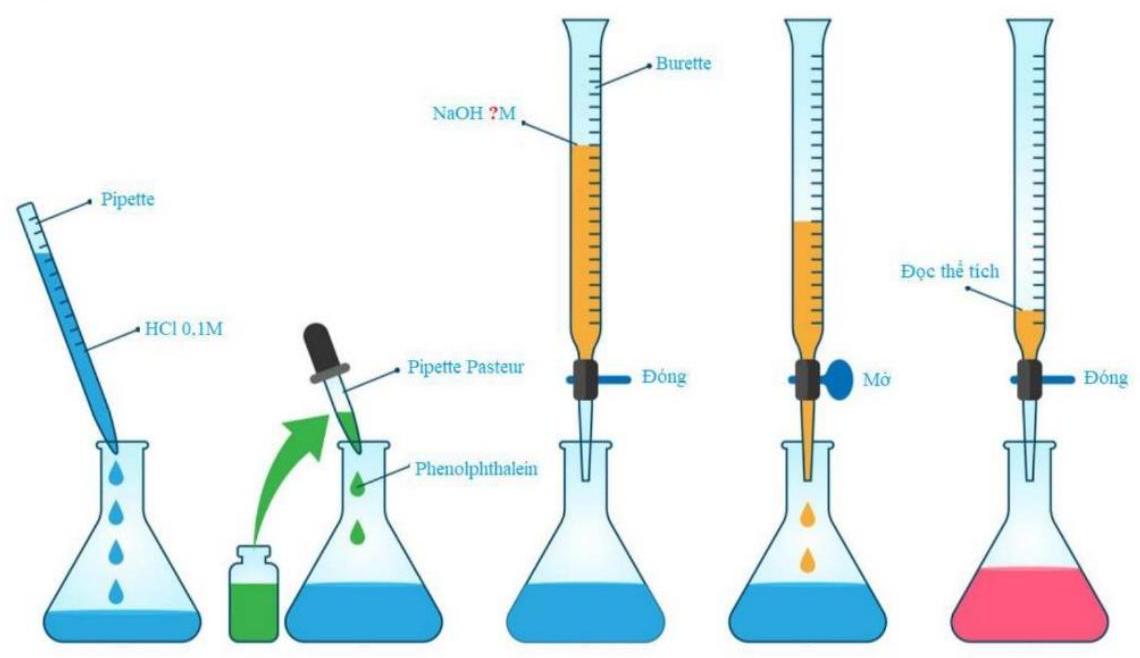
Trình bày sơ lược nguyên tắc của thí nghiệm này.
Lời giải
Lấy một lượng dung dịch ${\text{HCl}}$ đã biết chính xác nồng độ, cho từ từ dung dịch ${\text{NaOH}}$ cần chuẩn độ vào, phản ứng trung hòa sẽ xảy ra. Để nhận biết điểm tương đương ta dùng thêm chỉ thị là phenolphthalein. – Điểm tương đương là thời điểm ${\text{HCl}}$ hết, khi thêm 1 giọt ${\text{NaOH}}$ thì ${\text{pH}}$ dung dịch sẽ cao nên dung dịch chuyển sang màu hồng. Từ kết quả thể tích dung dịch ${\text{NaOH}}$ đã dùng, sẽ tính được nồng độ dung dịch ${\text{NaOH}}$ cần chuẩn độ.
III. BÀI TẬP TRẮC NGHIỆM
Câu 1. Dung dịch nào sau đây có ${\text{pH}} > 7$ ?
A. ${\text{HN}}{{\text{O}}_3}$
B. ${\text{KOH}}$
C. ${\text{C}}{{\text{H}}_3}{\text{OH}}$
D. ${\text{NaCl}}$
Câu 2. Đối với dung dịch acid yếu ${\text{C}}{{\text{H}}_3}{\text{COOH}}0,10{\text{M}}$, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. $\left[ {{{\text{H}}^ + }} \right] = 0,10{\text{M}}$.
B. $\left[ {{{\text{H}}^ + }} \right] < \left[ {{\text{C}}{{\text{H}}_3}{\text{CO}}{{\text{O}}^ – }} \right]$.
C. $\left[ {{{\text{H}}^ + }} \right] > \left[ {{\text{C}}{{\text{H}}_3}{\text{CO}}{{\text{O}}^ – }} \right]$.
D. $\left[ {{{\text{H}}^ + }} \right] < 0,10{\text{M}}$.
Câu 3. Chọn phát biểu đúng trong số các phát biểu sau đây?
A. Giá trị pH tăng thì độ acid tăng.
B. Dung dịch có ${\text{pH}} > 7$ làm quỳ tím hóa đỏ.
C. Dung dịch có ${\text{pH}} < 7$ làm quỳ tím hóa xanh.
D. Giá trị pH tăng thì độ acid giảm.
Câu 4. Chọn biểu thức đúng:
A. $\left[ {{{\text{H}}^ + }} \right] \cdot \left[ {{\text{O}}{{\text{H}}^ – }} \right] = {10^{ – 14}}$
B. $\left[ {{{\text{H}}^ + }} \right] \cdot \left[ {{\text{O}}{{\text{H}}^ – }} \right] = {10^{ – 7}}$
C. $\left[ {{{\text{H}}^ + }} \right] \cdot \left[ {{\text{O}}{{\text{H}}^ – }} \right] = 1$
D. $\left[ {{{\text{H}}^ + }} \right] + \left[ {{\text{O}}{{\text{H}}^ – }} \right] = 0$
Câu 5. Môi trường acid có ${\text{pH}}$ :
A. lớn hơn 7
B. nhỏ hơn 7
C. bằng 7
D. lớn hơn 8
Câu 6. Dung dịch nào làm quỳ tím hóa đỏ:
A. ${\text{HCl}}$
B. ${\text{KOH}}$
C. ${\text{NaOH}}$
D. ${\text{NaCl}}$
Câu 7. Cho phenolphtalein vào dung dịch nào sau đây sẽ hóa hồng?
A. Dung dịch ${\text{NaOH}}$
B. Dung dịch ${\text{HCl}}$
C. Dung dịch ${\text{NaCl}}$
D. Dung dịch ${\text{BaC}}{{\text{l}}_2}$
Câu 8. Đối với dung dịch acid mạnh ${\text{HN}}{{\text{O}}_3}0,10{\text{M}}$, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ ${\text{mol}}$ ion sau đây là đúng?
A. $\left[ {{{\text{H}}^ + }} \right] = 0,10{\text{M}}$.
C. $\left[ {{{\text{H}}^ + }} \right] > \left[ {{\text{NO}}_3^ – } \right]$.
B. $\left[ {{{\text{H}}^ + }} \right] < \left[ {{\text{NO}}_3^ – } \right]$.
D. $\left[ {{{\text{H}}^ + }} \right] < 0,10{\text{M}}$.
Câu 9. Dung dịch nào sau đây có ${\text{pH}} > 7$ ?
A. ${\text{HCl}}$
B. ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$
C. ${\text{NaCl}}$
D. ${\text{Ca}}{({\text{OH}})_2}$
Câu 10. Dung dịch nào sau đây có nồng độ ion ${{\text{H}}^ + }$cao nhất?
A. Cà phê đen ${\text{pH}} = 5$
B. Máu ${\text{pH}} = 7,4$
C. Thuốc tẩy dầu ${\text{pH}} = 11$
D. Nước chanh ${\text{pH}} = 2$
Câu 11. Nhóm các dung dịch đều có ${\text{pH}} < 7$ là:
A. ${\text{N}}{{\text{a}}_2}{\text{C}}{{\text{O}}_3},{\left( {{\text{N}}{{\text{H}}_4}} \right)_2}{\text{S}}{{\text{O}}_4},{\text{HCN}}$
B. ${\text{N}}{{\text{a}}_2}{\text{S}},{\text{KHS}}{{\text{O}}_4},{\text{HClO}}$
C. ${\text{HN}}{{\text{O}}_3},{\text{HCl}},{{\text{H}}_2}{\text{S}}{{\text{O}}_4}$
D. ${\text{KOH}},{\text{NaOH}},{\text{N}}{{\text{H}}_4}{\text{OH}}$
Câu 12. Cho các dung dịch ${\text{HCl}},{{\text{H}}_2}{\text{S}}{{\text{O}}_4}$ và ${\text{C}}{{\text{H}}_3}{\text{COOH}}$ có cùng giá trị ${\text{pH}}$. Sự sắp xếp nào sau đây đúng với giá trị nồng độ mol của các dung dịch trên ?
A. ${\text{HCl}} < {{\text{H}}_2}{\text{S}}{{\text{O}}_4} < {\text{C}}{{\text{H}}_3}{\text{COOH}}$
B. ${{\text{H}}_2}{\text{S}}{{\text{O}}_4} < {\text{HCl}} < {\text{C}}{{\text{H}}_3}{\text{COOH}}$
C. ${{\text{H}}_2}{\text{S}}{{\text{O}}_4} < {\text{C}}{{\text{H}}_3}{\text{COOH}} < {\text{HCl}}$
D. ${\text{C}}{{\text{H}}_3}{\text{COOH}} < {\text{HCl}} < {{\text{H}}_2}{\text{S}}{{\text{O}}_4}$
Câu 13. Chỉ dùng quỳ tím, có thể nhận biết ba dung dịch riêng biệt nào sau đây ?
A. ${\text{HCl}},{\text{NaN}}{{\text{O}}_3},{\text{Ba}}{({\text{OH}})_2}$
B. ${{\text{H}}_2}{\text{S}}{{\text{O}}_4},{\text{HCl}},{\text{KOH}}$.
C. ${{\text{H}}_2}{\text{S}}{{\text{O}}_4},{\text{NaOH}},{\text{KOH}}$
D. ${\text{Ba}}{({\text{OH}})_2},{\text{NaCl}},{{\text{H}}_2}{\text{S}}{{\text{O}}_4}$
Câu 14. Dung dịch ${\text{HCl}}$ có ${\text{pH}} = 3$, cần pha loãng dung dịch này bằng nước bao nhiêu lần để thu được dung dịch có ${\text{pH}} = 4$ ?
A. 10 lần
B. 1 lần
C. 12 lần
D. 100 lần
Câu 15. Khi hòa tan trong nước, chất nào sau đây làm cho quỳ tím chuyển màu xanh ?
A. ${\text{NaCl}}$.
B. ${\text{N}}{{\text{H}}_4}{\text{Cl}}$.
C. ${\text{NaOH}}$.
D. ${\text{FeC}}{{\text{l}}_3}$.
Câu 16. Hãy cho biết dãy các dung dịch nào sau đây có khả năng đổi màu quỳ tím sang đỏ (hồng)?
A. ${\text{C}}{{\text{H}}_3}{\text{COOH}},{\text{HCl}}$ và ${\text{BaC}}{{\text{l}}_2}$.
B. ${\text{NaOH}},{\text{N}}{{\text{a}}_2}{\text{C}}{{\text{O}}_3}$ và ${\text{N}}{{\text{a}}_2}{\text{S}}{{\text{O}}_3}$.
C. ${{\text{H}}_2}{\text{S}}{{\text{O}}_4},{\text{NaHC}}{{\text{O}}_3}$ và ${\text{AlC}}{{\text{l}}_3}$.
D. ${\text{NaHS}}{{\text{O}}_4},{\text{HCl}}$ và ${\text{AlC}}{{\text{l}}_3}$.
Câu 17. Cho các muối sau đây: ${\text{NaN}}{{\text{O}}_3};{{\text{K}}_2}{\text{C}}{{\text{O}}_3};{\text{CuS}}{{\text{O}}_4};{\text{FeC}}{{\text{l}}_3};{\text{AlC}}{{\text{l}}_3};{\text{KCl}}$. Các dung dịch có ${\text{pH}}$ bằng 7 là:
A. ${\text{NaN}}{{\text{O}}_3};{\text{KCl}}$.
B. ${{\text{K}}_2}{\text{C}}{{\text{O}}_3};{\text{CuS}}{{\text{O}}_4};{\text{KCl}}$.
C. ${\text{CuS}}{{\text{O}}_4};{\text{FeC}}{{\text{l}}_3};{\text{AlC}}{{\text{l}}_3}$.
D. ${\text{NaN}}{{\text{O}}_3};{{\text{K}}_2}{\text{C}}{{\text{O}}_3};{\text{CuS}}{{\text{O}}_4}$.
Câu 18. Câu nào sai khi nói về ${\text{pH}}$ của dung dịch ở ${25^ \circ }{\text{C}}$ ?
A. ${\text{pH}} = {\text{lg}}\left[ {{{\text{H}}^ + }} \right]$
B. ${\text{pH}}$ của nước là 7 .
C. $\left[ {{{\text{H}}^ + }} \right] \cdot \left[ {{\text{O}}{{\text{H}}^ – }} \right] = {10^{ – 14}}$
D. $\left[ {{{\text{H}}^ + }} \right] = {10^{ – {\text{pH}}}}$
Câu 19. Khi pha loãng dung dịch acid ${\text{HCl}}$ có ${\text{pH}} = {\text{a}}$ ta thu được dung dịch mới có:
A. ${\text{pH}} > {\text{a}}$
B. ${\text{pH}} = {\text{a}}$
C. ${\text{pH}} < {\text{a}}$
D. ${\text{pH}} = {\text{a}}/2$
Câu 20. Chọn ý sai trong các ý sau đây:
A. Trong dung dịch nước ở ${25^ \circ }{\text{C}}$ biểu thức $\left[ {{{\text{H}}^ + }} \right]\left[ {{\text{O}}{{\text{H}}^ – }} \right] = {10^{ – 14}}$ luôn đúng.
B. Nước ở ${25^ \circ }{\text{C}}$ có ${\text{pH}}$ bằng 7 .
C. Trong điều kiện bình thường, nước không thể điện li.
D. ${\text{pH}}$ là đại lượng liên hệ trực tiếp với ${{\text{H}}^ + }$
Câu 21. Để biết giá trị gần đúng của ${\text{pH}}$, có thể dùng:
A. Phenolphthalein
B. Methyl da cam
C. Qùy tím
D. Giấy chỉ thị ${\text{pH}}$
Câu 22. Trong môi trường acid, methyl da cam chỉ thị màu gì?
A. Đỏ
B. Vàng cam
C. Hồng
D. Xanh
Câu 23. Nếu cho phenolphthalein vào nước cốt chanh thì hiện tượng gì sẽ xảy ra?
A. Dung dịch sẽ chuyển sang màu hồng.
B. Dung dịch sẽ chuyển sang màu xanh dương.
C. Dung dịch sẽ chuyển từ màu đỏ sang màu vàng cam.
D. Không có hiện tượng gì.
Sử dụng hình ảnh dưới đây để trả lời các câu hỏi từ 24-27.
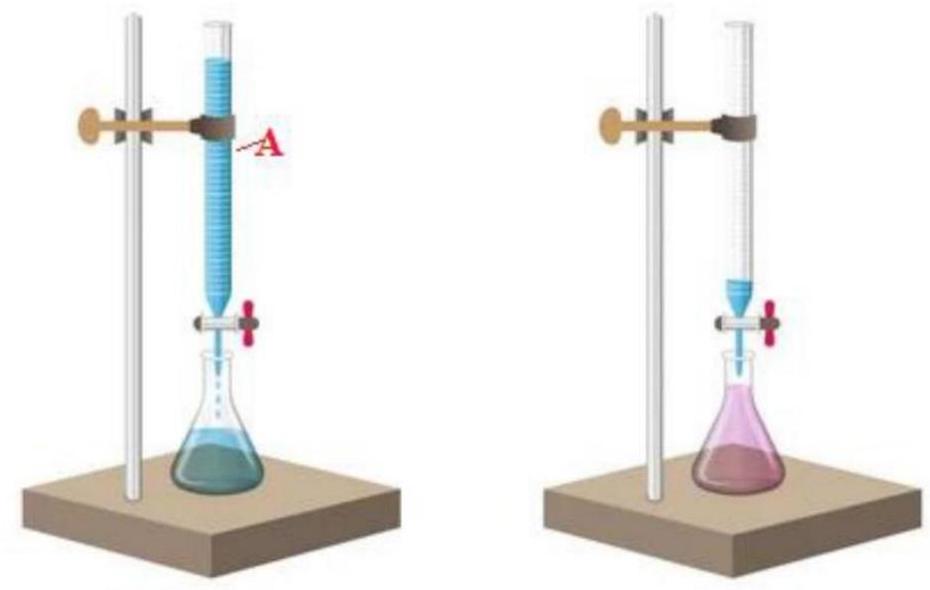
Câu 24. Hình ảnh trên mô tả phương pháp nào trong hóa học:
A. Phương pháp đo ${\text{pH}}$
B. Phương pháp chuẩn độ
C. Phương pháp tổng hợp hóa học
D. Phương pháp định lượng
Câu 25. Dụng cụ ${\text{A}}$ trên hình có tên là gì?
A. Erlen
B. Pipette
C. Burette
D. Becher
Câu 26. Dự đoán chất chỉ thị được sử dụng là gì?
A. Phenolphthalein
B. Methyl da cam
C. Xanh methylene
D. Đỏ methyl
Câu 27. Bình tam giác trong hình trên không thể là dung dịch của chất nào sau đây?
A. ${\text{HCl}}$
B. ${{\text{H}}_2}{\text{S}}{{\text{O}}_4}$
C. ${\text{HN}}{{\text{O}}_3}$
D. ${{\text{H}}_2}{\text{C}}{{\text{O}}_3}$
Câu 28. Mô tả nào sau đây là không đúng?
A. Dung dịch trong burette có thể là dung dịch ${\text{NaOH}}$ đã biết hoặc chưa biết nồng độ.
B. Dung dịch ${\text{HCl}}$ trong thí nghiệm trên có thể chưa xác định được nồng độ.
C. Khi dung dịch trong bình tam giác vừa chuyển sang màu hồng tức là lượng acid đã được trung hòa hết và thừa 1 lượng nhỏ base.
D. Chỉ thị phenolphthalein phải được cho vào sau khi khóa burette đã mở.
Câu 29. Điểm tương đương trong thí nghiệm trên là:
A. Thời điểm cho phenophtalein vào trong bình tam giác.
B. Thời điểm dung dịch trong bình tam giác vừa chuyển sang màu hồng.
C. Thời điểm giọt dung dịch đầu tiên từ burette rơi xuống bình tam giác.
D. Thời điểm dung dịch trong burette được đổ đầy tới vạch số 0 .
Câu 30. Nếu dùng methyl da cam thay cho phenolphthalein và thực hiện thí nghiệm tương tự thì điểm tương đương trong trường hợp này là:
A. Thời điểm dung dịch chuyển từ màu đỏ sang màu vàng cam.
B. Thời điểm dung dịch chuyển từ màu hồng sang không màu.
C. Thời điểm dung dịch chuyển từ màu vàng sang màu đỏ.
D. Thời điểm dung dịch chuyển từ màu đỏ sang màu xanh dương.
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 |
| B | D | D | A |
B |
|
6 |
7 | 8 | 9 | 10 |
| A | A | A | D |
D |
|
11 |
12 | 13 | 14 | 15 |
| C | B | A | A |
C |
|
16 |
17 | 18 | 19 | 20 |
| D | A | A | A |
C |
|
21 |
22 | 23 | 24 | 25 |
| D | A | D | B |
C |
|
26 |
27 | 28 | 29 | 30 |
| A | D | D | B |
A |
Lời giải trắc nghiệm
Câu 1.
Lời giải:
Dung dịch ${\text{KOH}}$ là dung dịch base nên có ${\text{pH}} > 7$.
Chọn B.
Câu 2.
Lời giải:
Vì là acid yếu nên ${\text{C}}{{\text{H}}_3}{\text{COOH}}$ phân ly không hoàn toàn dẫn đến $\left[ {{{\text{H}}^ + }} \right] < 0,10{\text{M}}$.
Chọn D.
Câu 3.
Lời giải:
Giá trị pH tăng thì độ kiềm tăng, độ acid giảm.
Chọn D.
Câu 4.
$\left[ {{{\text{H}}^ + }} \right] \cdot \left[ {{\text{O}}{{\text{H}}^ – }} \right] = {10^{ – 14}}$
Lời giải:
Chọn A.
Câu 5.
Lời giải:
Môi trường acid có ${\text{pH}} < 7$.
Chọn B.
Câu 6.
Lời giải:
pH tăng lên 1 đơn vị đồng nghĩa nồng độ ${{\text{H}}^ + }$giảm đi 10 lần $ \to $ pha loãng 10 lần. Chọn A.
Câu 15.
Lời giải:
${\text{NaOH}}$ là base nên khi hòa tan trong nước làm quỳ tím hóa xanh.
Chọn C.
Câu 16.
Lời giải:
${\text{HCl}}$ là acid nên làm quỳ tím hóa đỏ.
${\text{NaHS}}{{\text{O}}_4}$ khi trong dung dịch sẽ phân ly thành ${\text{N}}{{\text{a}}^ + }$và ${\text{HS}}{{\text{O}}_4}$.
${\text{HSO}}_4^ – + {{\text{H}}_2}{\text{O}} \leftrightharpoons {{\text{H}}_3}{{\text{O}}^ + } + {\text{S}}{{\text{O}}_4}{\;^{2 – }}$
${\text{AlC}}{{\text{l}}_3}$ khi trong dung dịch sẽ phân ly thành ${\text{A}}{{\text{l}}^{3 + }}$ và ${\text{C}}{{\text{l}}^ – }$.
${\text{A}}{{\text{l}}^{3 + }} + 3{{\text{H}}_2}{\text{O}} \leftrightharpoons {\text{Al}}{({\text{OH}})_3} + 3{{\text{H}}^ + }$
Chọn D.
Câu 17.
Lời giải:
Khi hòa tan trong nước, các muối sẽ phân ly thành ion, một số ion khi tác dụng với nước sẽ tạo ra ${{\text{H}}^ + }$hoặc ${\text{O}}{{\text{H}}^ – }$khiến ${\text{pH}}$ thay đồi.
${\text{A}}{{\text{l}}^{3 + }} + 3{{\text{H}}_2}{\text{O}} \leftrightharpoons {\text{Al}}{({\text{OH}})_3} + 3{{\text{H}}^ + }$
${\text{C}}{{\text{O}}_3}{\;^{2 – }} + {{\text{H}}_2}{\text{O}} \leftrightharpoons {\text{HC}}{{\text{O}}_3}{\;^ – } + {\text{O}}{{\text{H}}^ – }$
${\text{NaN}}{{\text{O}}_3}$ và ${\text{KCl}}$ khi phân ly tạo thành các ion không thủy phân trong nước nên ${\text{pH}}$ dung dịch vẫn bằng 7 .
Chọn A.
Câu 18.
Lời giải:
${\text{pH}} = – {\text{lg}}\left[ {{{\text{H}}^ + }} \right]$
Chọn A.
Câu 19.
Lời giải:
Khi pha loãng thì thể tích tăng nên nồng độ ${{\text{H}}^ + }$sẽ giảm, vì vậy ${\text{pH}}$ sẽ tăng.
$ \to {\text{pH}} > {\text{a}}$
Chọn A.
Câu 20.
Lời giải:
Nước có thể điện ly nhưng sự điện ly rất yếu.
Chọn C.
Câu 21.
Lời giải:
Phenolphthalein, methyl da cam và qùy tím chỉ cho biết dung dịch là acid hay base.
Chọn D.
Câu 22.
Lời giải:
Methyl da cam chỉ thị màu đỏ trong môi trường acid.
Chọn A.
Câu 23.
Lời giải:
Nước cốt chanh có tính acid, pH khoảng 2, khi cho phenolphthalein vào sẽ không làm đổi màu.
Chọn D.
Câu 24.
Lời giải:
Hình ảnh trên mô tả phương pháp chuẩn độ.
Chọn B.
Câu 25.
Lời giải:
Dụng cụ ${\text{A}}$ trên hình có tên là burette.
Chọn C.
Câu 26.
Lời giải:
Dự đoán chất chỉ thị được sử dụng là phenolphthalein vì chuyển từ không màu sang hồng.
Chọn A.
Câu 27.
Lời giải:
Nguyên tắc chuẩn độ acid – base là áp dụng với acid và base mạnh, ${{\text{H}}_2}{\text{C}}{{\text{O}}_3}$ là acid yếu.
Chọn D.
Câu 28.
Lời giải:
A. Đúng. Nếu dung dịch nằm trong burette đã biết nồng độ thì dung dịch trong bình tam gác chưa biết nồng độ và ngược lại.
B. Đúng.
C. Đúng.
D. Sai. Chỉ thị phenolphthalein phải được cho vào trước khi bắt đầu chuẩn độ.
Chọn D.
Câu 29.
Lời giải:
Điểm tương đương trong thí nghiệm trên là thời điểm dung dịch trong bình tam giác vừa chuyển sang màu hồng.
Chọn B.
Câu 30.
Lời giải:
Nếu dùng methyl da cam thay cho phenolphthalein thì điểm tương đương sẽ là thời điểm dung dịch chuyển từ màu đỏ sang màu vàng cam theo sự chuyển màu của methyl da cam.
Chọn A.