Trắc nghiệm Xác định hằng số điện li-Độ điện ly Hóa 11 có lời giải được soạn dưới dạng file word gồm 4 trang. Các bạn xem và tải về ở dưới.
Trắc nghiệm Xác Định Hằng Số Điện Li – Độ Điện Ly
I. KIẾN THỨC CƠ BẢN
1. Độ điện li
• Độ điện li $\alpha $ là tỉ số giữa số mol phân tử bị phân li thành ion trên tổng số mol phân tử tan trong dung dịch. Ta có $0 \leqslant \alpha \leqslant 1$ hay $0{\text{% }} \leqslant \alpha \leqslant 100{\text{% }}$.
• Chất không điện li tức là không bị phân li: $\alpha = 0$.
• Chất điện li mạnh thì sự phân li hoàn toàn: $\alpha = 1$ hay $100{\text{% }}$.
• Chất điện li yếu thì sự phân li không hoàn toàn $0 < \alpha < 1$.
2. Hằng số điện li
• Xét cân bằng: ${\text{AX}} \leftrightharpoons {{\text{A}}^ + } + {{\text{X}}^ – }$
• Khi tốc độ thuận bằng tốc độ nghịch trong dung dịch xuất hiện cân bằng điện li.
• Hằng số điện li xét đối với cân bằng (*) được xác định:
${\text{K}} = \frac{{\left[ {{{\text{A}}^ + }} \right] \cdot \left[ {{{\text{X}}^ – }} \right]}}{{\left[ {{\text{AX}}} \right]}}$
Trong đó $\left[ {{{\text{A}}^ + }} \right],\left[ {{{\text{X}}^ – }} \right],\left[ {{\text{AX}}} \right]$ là nồng độ các chất ở thời điểm cân bằng.
Lưu ý: Hằng số điện li chỉ phụ thuộc vào nhiệt độ, không phụ thuộc vào nồng độ.
3. Mở rộng
• Nước là chất điện li rất yếu
• Phương trình điện li: ${\text{H}}2{\text{O}} \leftrightharpoons {{\text{H}}^ + } + {\text{O}}{{\text{H}}^ – }$
Hằng số cân bằng của phản ứng: ${\text{K}} = \frac{{\left[ {{{\text{H}}^ + }} \right] \cdot \left[ {{\text{O}}{{\text{H}}^ – }} \right]}}{{\left[ {{{\text{H}}_2}{\text{O}}} \right]}}$
• Tích số ion của nước : ${{\text{K}}_{{\text{H}}2{\text{O}}}} = {\text{K}} \cdot \left[ {{{\text{H}}_2}{\text{O}}} \right] = \left[ {{{\text{H}}^ + }} \right] \cdot \left[ {{\text{O}}{{\text{H}}^ – }} \right]$
• Tích số ion của nước là hằng số xác định ở nhiệt độ xác định.
Ở $25,{\text{}}{{\text{K}}_{{\text{H}}2{\text{O}}}} = \left[ {{{\text{H}}^ + }} \right] \cdot \left[ {{\text{O}}{{\text{H}}^ – }} \right] = {10^{ – 14}}$
$ + \left[ {{{\text{H}}^ + }} \right] > \left[ {{\text{O}}{{\text{H}}^ – }} \right]$dung dịch có môi trường acid.
$ + \left[ {{{\text{H}}^ + }} \right] < \left[ {{\text{O}}{{\text{H}}^ – }} \right]$dung dịch có môi trường base.
$ + \left[ {{{\text{H}}^ + }} \right] = \left[ {{\text{O}}{{\text{H}}^ – }} \right]$dung dịch có môi trường trung tính.
II. VÍ DỤ MINH HỌA
Câu 1. Cho dung dịch ${\text{C}}{{\text{H}}_3}{\text{COOH}}$ $0,1{\text{M}}$. Hằng số phần li của acetic acid bằng $1,75 \cdot {10^{ – 5}}$. Tính độ điện li của dung dịch trên.
Lời giải:
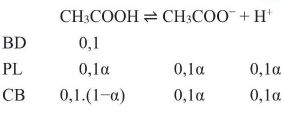
${\text{K}} = 1,75 \cdot {10^{ – 5}} = \frac{{{{(0,1 \cdot \alpha )}^2}}}{{0,1 \cdot \left( {1 – \alpha } \right)}} \to \alpha = 1,31 \cdot {10^{ – 2}}$
Câu 2. Tính hằng số điện li của acetic acid, biết rằng dung dịch $0,1{\text{M}}$ có độ điện li là $1,32{\text{% }}$.
Lời giải:

${\text{K}} = \frac{{{{(0,1 \cdot \alpha )}^2}}}{{0,1 \cdot \left( {1 – \alpha } \right)}} = \frac{{{{(0,1 \cdot 1,32{\text{% }})}^2}}}{{0,1 \cdot \left( {1 – 1,32{\text{% }}} \right)}} = 1,77 \cdot {10^{ – 5}}$
III. BÀI TẬP TẬP TRẮC NGHIỆM
Câu 1. Trong 2 lít dung dịch HF có chứa 4 gam HF nguyên chất. Độ điện li của acid này là $8{\text{% }}$. Tính hằng số phân li của acid HF?
A. $6,96 \cdot {10^{ – 4}}$
B. $7,96 \cdot {10^{ – 4}}$
C. $6,96 \cdot {10^{ – 3}}$
D. $6,{96.10^{ – 3}}$
Câu 2. Tính nồng độ ion ${{\text{H}}^ + }$ của dung dịch ${\text{C}}{{\text{H}}_3}{\text{COOH}}$ $0,1{\text{M}}$, biết hằng số phân li của acid ${{\text{K}}_{\text{a}}} = 1,75 \cdot {10^{ – 5}}$ ?
A. $2,32 \cdot {10^{ – 3}}$
B. $1,31 \cdot {10^{ – 3}}$
C. $2,52 \cdot {10^{ – 3}}$
D. $1,52 \cdot {10^{ – 3}}$
Câu 3. Dung dịch acid ${\text{HCOOH}}$ $0,1{\text{M}}$ ở 25 có độ điện li là $4,3{\text{% }}$. Hằng số phần li của ${\text{HCOOH}}$ là:
A. $1,932 \cdot {10^{ – 4}}$
B. $1,732 \cdot {10^{ – 4}}$
C. $1,932 \cdot {10^{ – 3}}$
D. $1,732 \cdot {10^{ – 3}}$
Câu 4. Tính nồng độ mol ion ${\text{O}}{{\text{H}}^ – }$có trong dung dịch ${\text{N}}{{\text{H}}_3}$ $0,1{\text{M}}$, biết hằng số phân li của base này là ${{\text{K}}_{\text{b}}} = 1,8 \cdot {10^{ – 5}}$ ?
A. $1,33 \cdot {10^{ – 3}}$
B. $2,33 \cdot {10^{ – 3}}$
C. $1,63 \cdot {10^{ – 3}}$
D. $2,{63.10^{ – 3}}$
Câu 5. Tính hằng số điện li và độ điện li của dung dịch ${\text{HCOOH}}$ $0,007{\text{M}}$, biết trong dung dịch có $\left[ {{{\text{H}}^ + }} \right] = 0,001{\text{M}}$ ?
A. $1,87 \cdot {10^{ – 3}}$ và 0,243
B. $1,67 \cdot {10^{ – 3}}$ và 0,143
C. $1,67 \cdot {10^{ – 3}}$ và 0,243
D. $1,87 \cdot {10^{ – 3}}$ và 0,143
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 |
| A | B | A | A |
B |
Câu 1.
Lời giải:
$\begin{array}{*{20}{c}}
{{{\text{n}}_{{\text{HF}}}} = 0,2{\text{mol}} \to \left[ {{\text{HF}}} \right] = 0,1{\text{M}}} \\
{{\text{HF}} \rightleftharpoons {{\text{H}}^ + } + {{\text{F}}^ – }}
\end{array}$
BD ${\text{}}0,1$
PL ${\text{}}0,1\alpha$ $0,1\alpha$ $0,1\alpha $
CB $0,1.\left( {1 – \alpha } \right)$ $0,1\alpha$ $0,1\alpha $
${\text{K}} = \frac{{{{(0,1 \cdot \alpha )}^2}}}{{0,1 \cdot \left( {1 – \alpha } \right)}} = \frac{{{{(0,1 \cdot 8{\text{% }})}^2}}}{{0,1 \cdot \left( {1 – 8{\text{% }}} \right)}} = 6,96 \cdot {10^{ – 4}}$
Chọn A.
Câu 2.
Lời giải:
Ta có: ${\text{C}}{{\text{H}}_3}{\text{COOH}} \leftrightharpoons {\text{C}}{{\text{H}}_3}{\text{CO}}{{\text{O}}^ – } + {{\text{H}}^ + }$
Ban đầu: $0,1$ $0$ $0$
Phân li: $x$ $x$ $x$
Cân bằng: $0,1-x$ $x$ $x$ (M)
${\text{K}} = \frac{{{{\text{x}}^2}}}{{0,1 – {\text{x}}}} = 1,75 \cdot {10^{ – 5}}$
$ \to {\text{x}} = 1,31 \cdot {10^{ – 3}}{\text{M}}$.
Chọn B.
Câu 3.
Lời giải:
Ta có: ${\text{HCOOH}} \leftrightharpoons {\text{HCO}}{{\text{O}}^ – } + {{\text{H}}^ + }$
Ban đầu: $0,1$ $0$ $0$
Phân li: $0,1\alpha$ $0,1\alpha$ $0,1\alpha $
Cân bằng: $0,1\left( {1 – \alpha } \right)$ $0,1\alpha$ $0,1\alpha$(M)
${\text{K}} = \frac{{{{(0,1\alpha )}^2}}}{{0,1\left( {1 – \alpha } \right)}} = \frac{{{{(0,1 \cdot 4,3{\text{% }})}^2}}}{{0,1\left( {1 – 4,3{\text{% }}} \right)}} = 1,932 \cdot {10^{ – 4}}$
Chọn A.
Câu 4.
Lời giải:
Ta có: ${\text{N}}{{\text{H}}_3} + {{\text{H}}_2}{\text{O}} \leftrightharpoons {\text{N}}{{\text{H}}_4}{^ + } + {\text{O}}{{\text{H}}^ – }$
Ban đầu: $0,1$ $0$ $0$
Phân li: $x$ $x$ $x$
Cân bằng: $0,1 – x$ $x$ $x$ (M)
${\text{K}} = \frac{{{{\text{x}}^2}}}{{0,1 – {\text{x}}}} = 1,8 \cdot {10^{ – 5}}$
$ \to {\text{x}} = 1,33 \cdot {10^{ – 3}}{\text{M}}$.
Chọn A.
Câu 5.
Lời giải:
Ta có: ${\text{HCOOH}} \leftrightharpoons {\text{HCO}}{{\text{O}}^ – } + {{\text{H}}^ + }$
Ban đầu: $0,007$
Phân li: $0,007\alpha$ $0,007\alpha$ $0,007\alpha$
Cân bằng: $0,007\left( {1 – \alpha } \right)$ $0,007\alpha$ $0,007\alpha$(M)
Độ điện ly: $0,001/0,007 = 1/7$.
${\text{K}} = \frac{{\left( {0,007} \right){\alpha ^2}}}{{0,007\left( {1 – \alpha } \right)}} = \frac{{{{\left( {\frac{{0,007 \cdot 1}}{7}} \right)}^2}}}{{0,007\left( {1 – \frac{1}{7}} \right)}} = 1,67 \cdot {10^{ – 3}}$
Chọn B.