Trắc nghiệm lý thuyết ammonia và muối ammonium Hóa 11 có đáp án được soạn dưới dạng file word gồm 10 trang. Các bạn xem và tải về ở dưới.
Trắc Nghiệm Lý Thuyết Ammonia Và Muối Ammonium
Câu 1. Tính base của $N{H_3}$ do:
A. Trên N còn cặp e tự do.
B. Phân tử có 3 liên kết cộng hóa trị phân cực.
C. $N{H_3}$ tan được nhiều trong nước.
D. $N{H_3}$ tác dụng với nước tạo $N{H_4}OH$.
Câu 2. Các liên kết N-H trong phân tử ammonia là liên kết:
A. Cộng hóa trị phân cực.
B. Cộng hóa trị không phân cực.
C. Liên kết ion.
D. Liên kết cho – nhận.
Câu 3. Độ tan của ammonia trong nước:
A. Không tan.
B. Khó tan.
C. Tan ít.
D. Tan nhiều.
Câu 4. Ammonia là chất khi có màu gì?
A. Nâu đỏ.
B. Xám nhạt.
C. Không màu.
D. Khói trắng.
Câu 5. Phân tử ammonia có thể tạo được liên kết hydrogen với:
A. Phân từ ammonia khác.
B. Phân tử nước.
C. Phân tử ammonia khác và với phân tử nước.
D. Không tạo được liên kết hydrogen.
Câu 6. Nhờ tạo được liên kết hydrogen với nước nên ammonia có tính chất nào sau đây?
A. Tính tan tốt trong nước.
B. Tính base yếu khi ở dạng dung dịch.
C. Tính khử khi tác dụng với một chất có tính oxi hóa.
D. Dễ bay hơi và có mùi khai, xốc.
Câu 7. Khi tan trong nước, ammonia:
A. Nhận $2{H^ + }$ của nước tạo thành ion $NH_5^{2 – }$
B. Phân ly thành ion ${H^ + }$và $N{H_2}{^ – }$
C. Nhận $O{H^ – }$của nước tạo thành ion $N{H_3}O{H^ – }$
D. Nhận ${H^ + }$của nước tạo thành ion $N{H_4}{^ + }$
Câu 8. Phương trình phân ly của $N{H_3}$ trong nước nào sau đây là đúng:
A. $N{H_3}\left( {aq} \right) + {H_2}O\left( l \right) \leftrightharpoons N{H_3}O{H^ – }\left( {aq} \right) + {H^ + }\left( {aq} \right)$
B. $N{H_3}\left( {aq} \right) + {H_2}O\left( l \right) \leftrightharpoons NH_2^ – \left( {aq} \right) + {H_3}{O^ + }\left( {aq} \right)$
C. $N{H_3}\left( {aq} \right) + {H_2}O\left( l \right) \leftrightharpoons NH_4^ + \left( {aq} \right) + O{H^ – }\left( {aq} \right)$
D. $N{H_3}\left( {aq} \right) + {H_2}O\left( l \right) \leftrightharpoons N{H_4}OH\left( l \right)$
Câu 9. Phản ứng nào sau đây chứng minh ammonia có tính base?
A. $4N{H_3}\left( g \right) + 5{O_2}\left( g \right) \to 4NO\left( g \right) + 6{H_2}O\left( g \right)$
B. $4N{O_2}\left( g \right) + 2{H_2}O\left( l \right) + {O_2}\left( g \right) \to 4HN{O_3}\left( {aq} \right)$
C. ${N_2}\left( g \right) + 3{H_2}\left( g \right) \leftrightharpoons 2N{H_3}\left( g \right)$
D. $N{H_3}\left( {aq} \right) + HCl\left( {aq} \right) \to N{H_4}Cl\left( {aq} \right)$
Câu 10. Khói trắng trong hình ảnh dưới đây là hợp chất nào?

A. $N{H_4}Cl$.
B. $NC{l_3}$.
C. $N{H_4}OH$.
D. $HN{O_3}$.
Câu 11. Chọn phương trình phản ứng đúng của thí nghiệm sau:
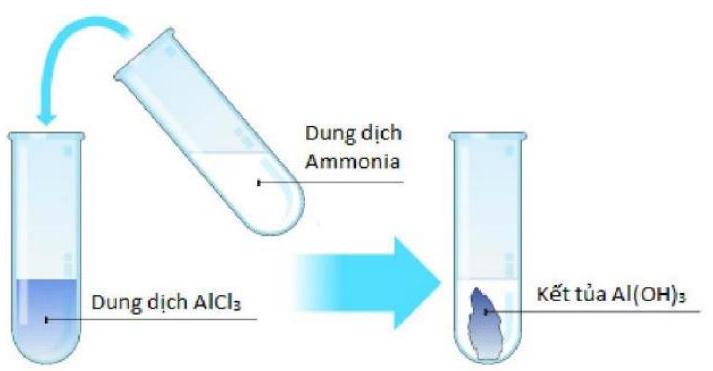
A. $2AlC{l_3}\left( {aq} \right) + 3N{H_4}OH\left( l \right) \to A{l_2}{O_3}\left( s \right) + 3HCl\left( {aq} \right) + 3N{H_3}\left( g \right)$
B. $AlC{l_3}\left( {aq} \right) + 3N{H_3}\left( {aq} \right) + 3{H_2}O\left( l \right) \to Al{(OH)_3}\left( s \right) + 3N{H_4}Cl\left( {aq} \right)$
C. $AlC{l_3}\left( {aq} \right) + 3N{H_3}\left( {aq} \right) + 3{H_2}O\left( l \right) \to Al\left( s \right) + 3N{H_4}OH\left( {aq} \right) + 3/2C{l_2}\left( g \right)$
D. $AlC{l_3}\left( {aq} \right) + 3N{H_3}\left( {aq} \right) + 3{H_2}O\left( l \right) \to Al{(OH)_3}\left( s \right) + 3N{H_3}\left( {aq} \right) + 3HCl\left( {aq} \right)$
Câu 12. Tính khử của $N{H_3}$ do:
A. Trên $N$ còn cặp e tự do.
B. Phân tử có 3 liên kết cộng hóa trị phân cực.
C. Trong phân tử $N{H_3}$, nguyên tử $N$ có số oxi hóa thấp là -3
D. $N{H_3}$ có tính base yếu.
Câu 13. Chọn ý sai khi nói về tính khử của ammonia:
A. Ammonia khử $CuO$ về dạng đơn chất.
B. Tính khử của ammonia là tính khử mạnh.
C. Dựa vào tính khử của ammonia mà người ta ứng dụng điều chế nitric acid.
D. Ammonia tác dụng với oxygen tạo thành nitrogen dioxide.
Câu 14. Trong quá trình tổng hợp ammonia theo quy trình Haber (Haber – Bosch), khi đạt trạng thái cân bằng, hỗn hợp khí sẽ được:
A. Qua hệ thống làm lạnh để loại ${N_2}$ và ${H_2}$.
B. Qua hệ thống làm lạnh để hóa lỏng $N{H_3}$.
C. Qua hệ thống lọc để loại bỏ tạp chất, bụi bẩn.
D. Qua hệ thống lọc để loại bỏ ${N_2}$ và ${H_2}$, thu $N{H_3}$ tinh khiết.
Câu 15. Trong quá trình tổng hợp ammonia theo quy trình Haber (Haber – Bosch), sau khi đã hóa lỏng $N{H_3}$, hydrogen và nitrogen sẽ:
A. Qua ống dẫn khí thải và được loại bỏ.
B. Đưa trở lại buồng phản ứng để tái sử dụng.
C. Tiếp tục qua lò phản ứng số 2 để tăng hiệu suất tổng hợp.
D. Hydrogen được tái sử dụng, còn nitrogen loại bỏ dựa vào tỉ trọng.
Câu 16. Trong quá trình tổng hợp ammonia theo quy trình Haber (Haber – Bosch), chọn câu đúng trong các phát biểu sau:
A. Điều kiện áp suất càng thấp thì hiệu suất càng cao.
B. Nhiệt độ càng thấp thì tốc độ phản ứng diễn ra càng nhanh.
C. Xúc tác có tác dụng làm cân bằng chuyển dịch theo chiều thuận.
D. Khi tăng nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều nghịch.
Câu 17. Vì sao trong quá trình tổng hợp ammonia theo quy trình Haber (Haber – Bosch) không thực hiện ở nhiệt độ thấp hơn để tăng hiệu suất?
A. Nhiệt độ thấp cân bằng sẽ chuyển dịch theo chiều nghịch.
B. Nhiệt độ thấp khí ${N_2}$ bị trơ nên phản ứng không xảy ra.
C. Nhiệt độ thấp hoạt động xúc tác của bột sắt bị suy giảm.
D. Nhiệt độ thấp thì tốc độ phản ứng bị chậm nên năng suất tổng hợp giảm.
Câu 18. Trong quá trình tổng hợp ammonia theo quy trình Haber (Haber – Bosch), xúc tác bột sắt có tác dụng:
A. Làm tăng hiệu suất phản ứng.
B. Làm chuyển dịch cân bằng hóa học theo chiều phản ứng thuận.
C. Làm tăng năng suất tổng hợp.
D. Làm tinh khiết sản phẩm tổng hợp.
Câu 19. Chọn câu sai khi nói về muối ammonium:
A. Là các hợp chất có chứa ion ammonium $\left( {N{H_4}{^ + }} \right)$
B. Hầu hết các muối này tan tốt trong nước.
C. Các muối ammonium tan tốt trong nước đều điện ly hoàn toàn.
D. Muối ammonium dạng rắn rất bền với nhiệt
Câu 20. Nguyên tố nitrogen có số oxi hóa trong các hợp chất: $N{H_3},N{H_4}Cl$ lần lượt là:
A. -3 và +3 .
B. -3 và +4 .
C. -3 và +5 .
D. -3 và -3 .
Câu 21. Có thể dùng chất nào sau đây để trung hòa ammonia?
A. Giấm ăn.
B. Muối ăn.
C. Baking soda.
D. Vôi.
Câu 22. Không khí trong phòng thí nghiệm bị ô nhiễm bởi khí $C{l_2}$. Để khử độc, có thể xịt vào không khí dung dịch nào sau đây?
A. Dung dịch $NaOH$.
B. Dung dịch $N{H_3}$.
C. Dung dịch $NaCl$.
D. Dung dịch ${H_2}S{O_4}$ loãng.
Câu 23. Phát biểu sai là:
A. Các muối ammonium đều dễ tan trong nước.
B. Các muối ammonium khi tan trong nước đều điện li hoàn toàn thành ion.
C. Các muối ammonium khi đun nóng đều bị phân hủy thành $N{H_3}$ và acid tương ứng.
D. Có thể dùng muối ammonium để đều chế $N{H_3}$ trong phòng thí nghiệm.
Câu 24. Nhận định đúng là
A. Các muối ammonium đều lưỡng tính.
B. Các muối ammonium đều thăng hoa.
C. Urea cũng là muối ammonium.
D. Phản ứng nhiệt phân $N{H_4}N{O_3}$ là phản ứng tự oxi hóa, tự khử.
Câu 25. Khí nitrogen có thể được tạo thành phản ứng hóa học nào sau đây?
A. Đốt cháy $N{H_3}$ trong oxygen có chất xúc tác $Pt$.
B. Nhiệt phân $N{H_4}N{O_3}$.
C. Nhiệt phân $AgN{O_3}$.
D. Nhiệt phân $N{H_4}N{O_2}$.
Câu 26. Nhận xét đúng về muối ammonium là:
A. Muối ammonium là tinh thể ion, phân tử gồm cation ammonium và anion hydroxide.
B. Tất cả các muối ammonium đều dễ tan trong nước, khi tan điện li hòa toàn thành cation ammonium và anion gốc acid.
C. Dung dịch muối ammonium tác dụng với dung dịch kiềm đặc, nóng cho thoát ra chất khí làm quỳ tím hóa đỏ.
D. Khi nhiệt phân muối ammonium luôn luôn có khí ammonia thoát ra.
Câu 27. Dung dịch ammonia có tính base do:
A. Ammonia tan nhiều trong nước.
B. Phân tử ammonia là phân tử có cực.
C. Khi tan trong nước, ammonia kết hợp với nước tạo ra các ion $N{H_4}{^ + }$và ${H_3}{O^ + }$.
D. Khi tan trong nước, các phân tử ammonia kết hợp với ion ${H^ + }$của nước tạo $N{H_4}{^ + }$và $O{H^ – }$
Câu 28. Dung dịch ammonia có thể hòa tan được $Zn{(OH)_2}$ là do:
A. $Zn{(OH)_2}$ là hydroxide lưỡng tính.
B. $Zn{(OH)_2}$ là một base ít tan.
C. Có khả năng tạo thành phức chất tan .
D. $N{H_3}$ là một hợp chất có cực và là một base yếu.
Câu 29. Hiện tượng thu được khi cho muối ammonium tác dụng với dung dịch kiềm là:
A. Thoát ra một chất khí màu lục nhạt.
B. Thoát ra một chất khí không màu, mùi khai, làm xanh giấy quỳ tím ẩm.
C. Thoát ra một chất khí màu nâu đỏ, làm xanh giấy quỳ tím ẩm.
D. Thoát ra chất khí không màu, không mùi.
Câu 30. Để tạo độ xốp cho một số loại bánh, có thể dùng muối nào sau đây?
A. ${\left( {N{H_4}} \right)_3}P{O_4}$.
B. $N{H_4}HC{O_3}$.
C. $CaC{O_3}$.
D. $NaCl$.
Câu 31. Có thể nhận biết muối ammonium nhờ phản ứng của muối ammonium với dung dịch kiềm mạnh, đun nóng . Khi đó, từ ống nghiệm đựng muối ammonium sẽ thấy:
A. Muối nóng chảy ở nhiệt độ không xác định.
B. Thoát ra chất khí có màu nâu đỏ.
C. Thoát ra chất khí không màu,có mùi xốc.
D. Thoát ra chất khí không màu, mùi khai.
Câu 32. Nhận định đúng là:
A. Các muối ammonium chứa gốc acid có tính oxi hóa không bị nhiệt phân.
B. Dung dịch $N{H_3}$ hoà tan $Zn{(OH)_2}$ do $Zn{(OH)_2}$ lưỡng tính.
C. Các muối ammonium dễ bị phân hủy bởi nhiệt.
D. Khí ammonia làm hồng quỳ tím ẩm.
Câu 33. Phát biểu đúng là:
A. $N{H_3}$ là chất oxi hóa mạnh.
B. $N{H_3}$ có tính khử mạnh, tính oxi hóa yếu.
C. $N{H_3}$ là chất khử mạnh.
D. $N{H_3}$ có tính oxi hóa mạnh, tính khử yếu.
Câu 34. Thuốc thử dùng để phân biệt dung dịch $N{H_4}N{O_3}$ với dung dịch ${\left( {N{H_4}} \right)_2}S{O_4}$ là:
A. $Cu$ và dung dịch $HCl$.
B. $CuO$ và dung dịch $HCl$.
C. $CuO$ và dung dịch $NaOH$.
D. Dung dịch $NaOH$ và dung dịch $HCl$.
Câu 35. Hiện tượng quan sát được (tại vị trí chứa $CuO$ ) khi dẫn khí $N{H_3}$ đi qua ống đựng bột $CuO$ nung nóng là:
A. $CuO$ từ màu đen chuyển sang màu trắng.
B. $CuO$ không thay đổi màu.
C. $CuO$ từ màu đen chuyển sang màu đỏ.
D. $CuO$ từ màu đen chuyển sang màu xanh.
Câu 36. Đun nóng $N{H_4}Cl$ như hình bên thấy có hiện tượng khói trắng trong ống nghiệm. Khói trắng trong ống nghiệm là chất nào sau đây ?
A. $HCl$
B. $N{H_3}$
C. $N{H_4}Cl$
D. $C{l_2}$

Câu 37. Ammonium chloride $\left( {N{H_4}Cl} \right)$ là chất rắn, màu trắng là nguyên liệu sản xuất phân bón $90\% $ cung cấp nguyên tố nitrogen (đạm) cho cây trồng, nên đôi khi được gọi là đạm chloride. Là loại phân sinh lý chua, nên bón kết hợp với lân và các loại phân bón khác.

Loại liên kết nào không có trong phân tử $N{H_4}Cl$ là
A. Liên kết cộng hóa trị phân cực
B. Liên kết ion
C. Liên kết cho – nhận
D. Liên kết cộng hóa trị không phân cực
Câu 38. Có các loại phân bón như $N{H_4}Cl,N{H_4}N{O_3},{\left( {N{H_4}} \right)_2}S{O_4}$ các loại phân bón này không thích hợp bón cho đất nào sau đây?
A. Đất chua
B. Đất phù sa
C. Đất bạc màu
D. Đất nghèo dinh dưỡng.
Câu 39. Trong thực tế để làm sạch lớp oxide trên bề mặt kim loại trước khi hàn người ta thường dung một chất rắn màu trắng. Chất rắn đó là
A. $NaCl$.
B. Bột đá vôi.
C. $N{H_4}Cl$.
D. Nước đá.
Câu 40. Chỉ dùng dung dịch $N{H_3}$ có thể nhận biết được dãy chất nào sau đây?
A. $AlC{l_3},MgC{l_2},NaCl$.
B. $ZnC{l_2},MgC{l_2},KCl$.
C. $HCl,{H_2}S{O_4},N{a_2}S{O_4}$.
D. $CuC{l_2},Ba{\left( {N{O_3}} \right)_2},{\left( {N{H_4}} \right)_2}S{O_4}$.
Câu 41. Cho các dung dịch ${\left( {N{H_4}} \right)_2}S{O_4},{\left( {N{H_4}} \right)_2}C{O_3}$ và dung dịch $N{H_3}$ loãng. Chọn thuốc thử để nhận biết các dung dịch trên?
A. Dung dịch ${H_2}S{O_4}$ loãng.
B. Dung dịch $HCl$ loãng.
C. Dung dịch $MgC{l_2}$.
D. Dung dịch $AlC{l_3}$.
Câu 42. Nhúng 2 đũa thuỷ tinh vào 2 bình đựng dung dịch $HCl$ đặc và $N{H_3}$ đặc. Sau đó đưa 2 đũa lại gần nhau thì thấy xuất hiện:
A. Khói màu trắng.
B. Khói màu tím.
C. Khói màu nâu.
D. Khói màu vàng.
Câu 43. Hiện tượng xảy ra khi cho giấy quỳ khô vào bình đựng khí amoniac là:
A. Giấy quỳ chuyển sang màu đỏ.
B. Giấy quỳ chuyển sang màu xanh.
C. Giấy quỳ mất màu.
D. Giấy quỳ không chuyển màu.
Câu 44. Có 4 dung dịch muối riêng biệt: $CuC{l_2},ZnC{l_2},FeC{l_3},AlC{l_3}$. Nếu thêm dung dịch $KOH$ dư, rồi thêm tiếp dung dịch $N{H_3}$ dư vào 4 dung dịch trên thì số chất kết tủa thu được là:
A. 1 .
B. 3 .
C. 2 .
D. 4 .
Câu 45. Cho các tính chất sau:
(1) Hòa tan tốt trong nước,
(2) Nặng hơn không khí,
(3) Tác dụng với acid.
(4) Làm xanh quỳ tím ẩm,
(5) Khử được hydrogen.
Những tính chất của $N{H_3}$ là:
A. $1,4,5$.
B. $1,2,3$.
C. $1,3,4$.
D. $2,4,5$.
Câu 46. 80% ammonia được sản xuất ra được sử dụng để:
A. Sản xuất phân bón (đạm ammonium, urea,..).
B. Sản xuất nitric acid.
C. Sử dụng như một chất làm lạnh trong các hệ thống làm lạnh công nghiệp.
D. Làm dung môi để hòa tan các hợp chất.
Câu 47. Khi oxi hóa bằng oxygen với xúc tác Pt ở nhiệt độ cao sẽ tạo thành
A. ${N_2}$.
B. NO.
C. $N{O_2}$.
D. $N{H_4}N{O_3}$.
Câu 48. Hỗn hợp khí nitrogen và hydrogen được sử dụng làm nguyên liệu đầu vào trong tổng hợp ammonia theo quy trình Haber có tỉ lệ số mol là:
A. $1:2$.
B. $1:3$.
C. $1:1$.
D. 2:3.
Câu 49. Để tạo độ xốp cho một số loại bánh, người ta thường dùng muối nào sau đây trong quá trình làm bánh?
A. ${\left( {N{H_4}} \right)_2}S{O_4}$.
B. $N{H_4}HC{O_3}$.
C. $N{H_4}Cl$.
D. $N{H_4}N{O_3}$.
Câu 50. Để tách riêng $N{H_3}$ ra khỏi hỗn hợp gồm ${N_2},{H_2},N{H_3}$, người ta có thể:
A. Cho hỗn hợp qua nước vôi trong dư
B. Cho hỗn hợp qua bột $CuO$ nung nóng.
C. Nén và làm lạnh hỗn hợp để hóa lỏng $N{H_3}$.
D. Cho hỗn hợp qua dung dịch ${H_2}S{O_4}$ đặc
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 |
|
A |
A | D | C | C |
|
6 |
7 | 8 | 9 | 10 |
|
A |
A | C | D | A |
|
11 |
12 | 13 | 14 | 15 |
| B | C | D | B |
B |
|
16 |
17 | 18 | 19 | 20 |
| D | D | C | D |
D |
|
21 |
22 | 23 | 24 | 25 |
| A | B | C | D |
D |
|
26 |
27 | 28 | 29 | 30 |
| D | D | C | B |
B |
|
31 |
32 | 33 | 34 | 35 |
| D | C | C | A |
C |
|
36 |
37 | 38 | 39 | 40 |
| C | D | A | C |
B |
| 41 | 42 | 43 | 44 |
45 |
| D | A | D | A |
C |
| 46 | 47 | 48 | 49 |
50 |
| A | B | B | B |
B |