Đề thi học kỳ 1 Hóa 11 Kết nối tri thức có đáp án-Đề 1 được soạn dưới dạng file word và PDF gồm 4 trang. Các bạn xem và tải về ở dưới.
I. PHẦN TRẮC NGHIỆM:
Câu 1. Dung dịch nào sau đây có khả năng dẫn điện?
A. Dung dịch đường.
B. Dung dịch rượu.
C. Dung dịch muối ăn.
D. Dung dịch benzene trong alcohol.
Câu 2. Tỉ khối hơi cuả chất $X$ so với ${H_2}$ bằng 44 . Phân tử khối của $X$ là
A. 88
B. 46
C. 22
D. 44
Câu 3. Dựa vào phổ hồng ngoại (IR) của $X\left( {HCOOC{H_3}} \right)$ dưới đây, hãy chỉ ra peak nào giúp dự đoán $X$ có nhóm $C = O$ và nhóm $C – O$ ?
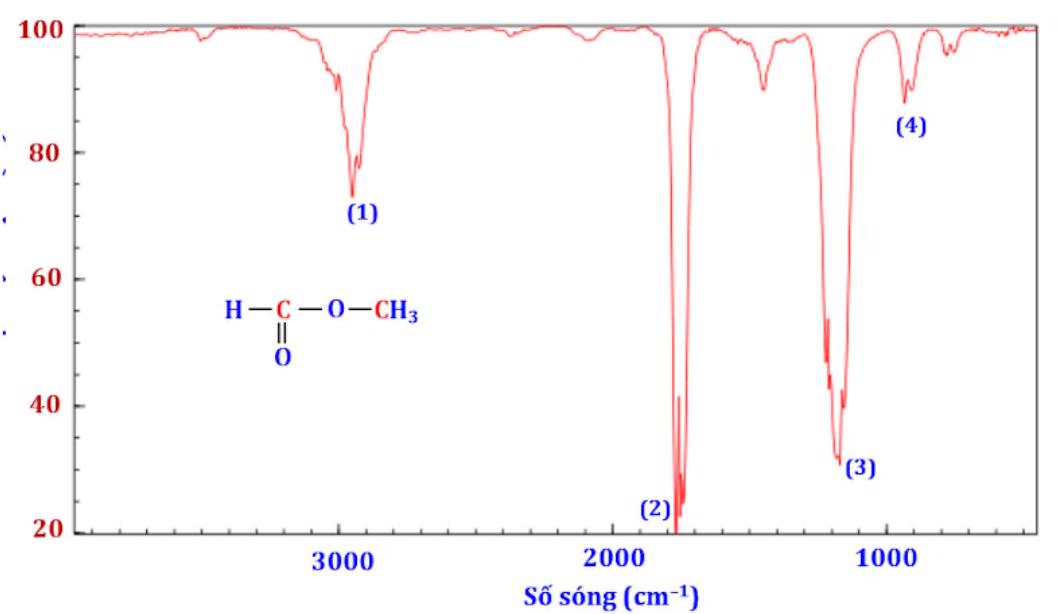
A. (1) và (2).
B. (2) và (3).
C. (3) và (4).
D. (2) và (4).
Câu 4. Cho các chất: $S,S{O_2},S{O_3},{H_2}S{O_4}$. Số chất vừa có tính oxi hoá, vừa có tính khử là
A. 1 .
B. 3 .
C. 2 .
D. 4 .
Câu 5. Hai chất có công thức:
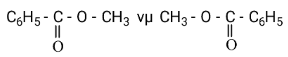
Nhận xét nào sau đây đúng?
A. Là các công thức của hai chất có cùng công thức phân tử nhưng có cấu tạo khác nhau.
B. Là các công thức của hai chất có cùng công thức phân tử những có cấu tạo tương tự nhau.
C. Là các công thức của hai chất có công thức phân tử và cấu tạo đều khác nhau.
D. Chỉ là công thức của một chất vì công thức phân tử và cấu tạo đều giống nhau.
Câu 6. Hầu hết các kim loại được tìm thấy dưới dạng quặng trên bề mặt Trái đất và trải qua nhiều quá trình để tách được kim loại ra khỏi quặng. Quặng nào dưới đây không tạo thành sulfur dioxide khi nung trong lò cao?
A. Chu sa.
B. Pyrite.
C. Thạch cao.
D. Chalcopyrite.
Câu 7. Từ phổ $MS$ của ethanol, người ta xác định được ion phân tử $\left[ {{C_2}{H_6}{O^ + }} \right]$có giá trị $m/z$ bằng 46 . Vậy, phân tử khối của ethanol là
A. 48 .
B. 47.
C. 45 .
D. 46 .
Câu 8. Cho các phản ứng sau:
(1) ${N_2}\left( {\;g} \right) + {O_2}\left( {\;g} \right)$ $\xrightarrow{{{t^0}}}$ $2NO\left( g \right)$;
(2) ${N_2}\left( {\;g} \right) + 3{H_2}\left( {\;g} \right)$ $\xrightarrow{{{t^0}}}$$2N{H_3}\left( {\;g} \right)$
Trong hai phản ứng trên thì nitrogen
A. thể hiện cả tính khử và tính oxi hóa.
B. không thể hiện tính khử và tính oxi hóa.
C. chỉ thể hiện tính oxi hóa.
D. chỉ thể hiện tính khử.
Câu 9. Nhóm các chất nào sau đây tác dụng với dung dịch ${H_2}S{O_4}$ loãng chỉ xảy ra phản ứng trao đổi?
A. $Fe{(OH)_3},Mg,CuO,KHC{O_3}$.
B. $Fe,CuO,Cu{(OH)_2},BaC{l_2}$.
C. $FeO,Cu{(OH)_2},BaC{l_2},N{a_2}C{O_3}$.
D. $F{e_2}{O_3},Cu{(OH)_2},Zn,N{a_2}S{O_3}$.
Câu 10. Cho $ZnO$ tác dụng với $HN{O_3}$ thì sản phẩm thu được là
A. $Zn{\left( {N{O_3}} \right)_2},\;{N_2}$.
B. $Zn{\left( {N{O_3}} \right)_2},N{O_2},{H_2}O$.
C. $Zn{\left( {N{O_3}} \right)_2},NO,{H_2}O$.
D. $Zn{\left( {N{O_3}} \right)_2},{H_2}O$.
Câu 11. Cho phản ứng nung vôi: $CaC{O_3}\left( s \right) \rightleftharpoons CaO\left( s \right) + C{O_2}\left( g \right), \,{\Delta _r}H_{298}^o > 0$.
Để tăng hiệu suất của phản ứng thì biện pháp nào sau đây không phù hợp?
A. Tăng nhiệt độ trong lò.
B. Tăng áp suất trong lò.
C. Đập nhỏ đá vôi.
D. Giảm áp suất trong lò.
Câu 12. $S{O_2}$ là chất khí
A. không màu, mùi hắc.
B. tan ít trong nước.
C. nhẹ hơn không khí.
D. không độc.
Câu 13. Yếu tố nào sau đây không ảnh hưởng đến cân bằng hóa học ?
(1) nồng độ (2) nhiệt độ (3) chất xúc tác (4) áp suất (5) diện tích bề mặt.
A. (2), (3), (5).
B. (1), (2), (4).
C. (3), (4).
D. (3), (5).
Câu 14. Cho FeS tác dụng với dung dịch ${H_2}S{O_4}$ loãng, thu được khí (A); nếu dùng dung dịch ${H_2}S{O_4}$ đặc, nóng thì thu được khí $\left( B \right)$. Dẫn khí $\left( B \right)$ vào dung dịch của $\left( A \right)$ thu được rắn $\left( C \right)$. Các chất $\left( A \right)$, (B), (C) lần lượt là
A. ${H_2},S{O_2},\;S$.
B. ${O_2},S{O_2},S{O_3}$.
C. ${H_2},{H_2}\;S,\;S$.
D. ${H_2}\;S,S{O_2},\;S$.
Câu 15. Thành phần phần trăm về khối lượng $C,H,O$ trong phân tử ethanol ${C_2}{H_5}OH$ lần lượt là
A. $53,33\% ;13,04\% ;33,63\% $.
B. $52,17\% ;13,04\% ;34,25\% $.
C. $52,71\% ;17,39\% ;29,90\% $.
D. $53,33\% ;11,11\% ;35,56\% $.
Câu 16. Cho sơ đồ chuyển hoá sau:
$X\xrightarrow{{ + {O_2}}}Y\xrightarrow{{{O_2}}}Z\xrightarrow{{ + {O_2} + {H_2}O}}W$
Biết rằng, $X,Y,Z,W$ đều chứa nitrogen; $X$ và $W$ có thể phản ứng với nhau tạo thành muối tan trong nước. Chất $X$ phù hợp với sơ đồ trên là
A. $N{O_2}$.
B. $N{H_3}$.
C. NO.
D. $HN{O_3}$.
Câu 17. Trong thành phần phân tử hợp chất hữu cơ nhất thiết phải có nguyên tố
A. Hydrogen.
B. Carbon
C. Nitrogen.
D. Oxygen.
Câu 18. Ở nhiệt độ thường, nitrogen kém hoạt động hóa học là do
A. phân tử nitrogen có liên kết ba khá bền.
B. phân tử nitrogen không phân cực.
C. nitrogen có bán kính nguyên tử nhỏ.
D. nitrogen có độ âm điện lớn nhất trong nhóm.
Câu 19. Trong thực tế việc chưng cất tiến hành thuận lợi khi chất lỏng có nhiệt độ sôi khoảng
A. ${10^0}C – {40^0}C$
B. ${50^0}C – {140^0}C$
C. ${40^0}C – {150^0}C$
D. ${30^0}C – {100^0}C$
Câu 20. Phương trình điện li nào dưới đây viết không đúng?
A. $HCl \to {H^ + } + C{l^ – }$.
B. $C{H_3}COOH \to {H^ + } + C{H_3}CO{O^ – }$.
C. $HClO \to {H^ + } + Cl{O^ – }$.
D. $N{a_3}P{O_4} \to 3N{a^ + } + PO_4^{3 – }$.
Câu 21. Dãy nào sau đây là dẫn xuất của hydrocarbon?
A. ${C_2}{H_6}O,{C_6}{H_6},CaC{O_3}$
B. $C{H_3}N{O_2},CaC{O_3},{C_6}{H_6}$
C. ${C_2}{H_6}O,{C_6}{H_6},C{H_3}N{O_2}$
D. $C{H_3}N{O_2},{C_2}{H_6}O,{C_2}{H_3}{O_2}Na$
Câu 22. Lựa chọn sản phẩm thích hợp điền vào chỗ trống trong cân bằng sau:
$HCO_3^ – + {H_2}O$ $ \to \boxed{} + {H_3}{O^ + }$
A. $O{H^ – }$.
B. ${H^ + }$.
C. ${H_2}C{O_3}$.
D. $CO_3^{2 – }$.
Câu 23. Dãy gồm các chất đều phản ứng được với $N{H_3}$ là
A. $HN{O_3}$ (aq), ${H_2}S{O_4}$ (aq), $N{a_2}O$ (s).
B. $HCl\left( {aq} \right),{O_2}\left( {\;g,{t^O}} \right),AlC{l_3}\left( {aq} \right)$.
C. ${H_2}S{O_4}\left( {aq} \right),{H_2}\;S\left( {aq} \right),NaOH\left( {aq} \right)$.
D. $HCl$ (aq), $FeC{l_3}$ (aq), $N{a_2}C{O_3}$ (aq).
Câu 24. Sự dịch chuyển cân bằng hoá học là sự di chuyển từ trạng thái cân bằng hoá học này
A. sang trạng thái không cân bằng do tác động của các yếu tố từ bên ngoài tác động lên cân bằng. bằng.
B. sang trạng thái cân bằng hoá học khác do tác động của các yếu tố từ bên ngoài tác động lên cân
C. sang trạng thái cân bằng hoá học khác do cân bằng hóa học tác động lên các yếu tố bên ngoài.
D. sang trạng thái cân bằng hoá học khác không cần có tác động của các yếu tố từ bên ngoài tác động lên cân bằng.
Câu 25. Phát biểu nào sau đây không đúng ?
A. Trong điều kiện thường, $N{H_3}$ là khí không màu, mùi khai.
B. Khí $N{H_3}$ nhẹ hơn không khí.
C. Phân tử $N{H_3}$ chứa các liên kết cộng hóa trị không phân cực.
D. Khí $N{H_3}$ tan nhiều trong nước.
Câu 26. Hydrocarbon $X$ có phần trăm khối lượng của carbon là $82,76\% $. Công thức phân tử của $X$ là
A. ${C_3}{H_6}$.
B. ${C_4}{H_{10}}$.
C. ${C_2}{H_5}$.
D. ${C_5}{H_{12}}$.
Câu 27. Khí ammonia làm giấy quỳ tím ẩm
A. chuyển thành màu xanh.
B. không đổi màu.
C. mất màu.
D. chuyển thành màu đỏ.
Câu 28. Cách làm nào sau đây là phương pháp kết tinh
A. Thu đường kính từ nước mía.
B. Tách dầu ăn ra khỏi hỗn hợp dầu ăn và nước.
C. Thu tinh dầu cam từ vỏ cam.
D. Thu curcumin từ củ nghệ.
II. PHẦN TỰ LUẬN:
Câu 1. Khi đánh bắt hải sản xa bờ, các ngư dân thường thu được lượng hải sản lớn. Để cho hải sản luôn tươi ngon khi vào bờ, họ thường ướp chúng bằng đá. Tuy nhiên, việc sử dụng đá làm cho thuyền nặng, chiếm diện tích nên một số ngư dân đã sử dụng urea thay thế.
a) Em hãy giải thích tại sao urea được dùng để ướp hải sản?
b) Các thực phẩm được ngâm trong phân urea có tốt cho sức khỏe không? Vì sao?
Câu 2. Đốt cháy hoàn toàn 6,5 gam một mẫu sulfur không tinh khiết (có chứa tạp chất không cháy) trong oxygen thu được 4,958 lít khí $S{O_2}$ ở đkc. Tìm thể tích $kh{\’i _2}$ (đkc) cần dùng và độ tinh khiết của mẫu sulfur.
Câu 3. Geraniol là dẫn xuất chứa 1 nguyên tử oxygen của teepen có trong tinh dầu hoa hồng, có mùi thơm đặc trưng và là một đơn hương quý dùng trong công nghiệp hương liệu và thực phẩm. Khi phân tích nguyên tố của geraniol người ta thu được $77,92\% C,11,7\% H$ về khối lượng và còn lại là oxygen. Xác định công thức phân tử của geraniol.

HƯỚNG DẪN GIẢI
I. PHẦN TRẮC NGHIỆM
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| C | A | B | C | D | C | D |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| A | C | D | B | A | D | D |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| B | B | B | A | C | C | D |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| D | B | B | C | B | A | A |
II. PHẦN TỰ LUẬN:
Câu 1.
a) Urea có công thức hoá học là ${\left( {N{H_2}} \right)_2}CO$. Khi hòa tan trong nước, urea thu một nhiệt lượng khá lớn vì vậy nó làm lạnh môi trường xung quanh và ngăn cản khả năng hoạt động của vi sinh vật. Nhờ đặc tính này người ta dùng urea bảo quản hải sản.
b) Các thực phẩm được ngâm trong urea không tốt cho sức khỏe.
Vì: Urea hòa tan vào nước: ${\left( {N{H_2}} \right)_2}CO + {H_2}O \to 2N{H_3} + C{O_2}$
Sau đó: $\;N{H_3} \to NH_4^ + \to NO_2^ – \to NO_3^ – $
Quá trình phân giải urea tạo ra muối nitrate. Nếu ăn phải thực phẩm được ngâm urea thì lượng nitrite tích tụ dần mỗi ngày gây giảm hoạt động của tuyến giáp, rối loạn thần kinh. Một số trường hợp ngộ độc cấp tính với các dấu hiệu đau bụng, buồn nôn, tiêu chảy, nếu không cấp cứu kịp thời thì dẫn đến tử vong. Vì vậy không được dùng urea để ướp cá, bảo quản thực phẩm.
Câu 2. Phương trình phản ứng: $S + {O_2}\xrightarrow{{{t^0}}}S{O_2}$
Dựa vào phương trình phản ứng ta có: ${n_S} = {n_{{O_2}}} = {n_{S{O_2}}} = \frac{{4,958}}{{24,79}} = 0,2$ mol.
$ \Rightarrow {V_{{O_2}}} = 0,2 \cdot 24,79 = 4,958$ lít.
Độ tinh khiết của mẫu lưu huỳnh là: $\frac{{0,2.32}}{{6,5}} \cdot 100\% = 98,46\% $
Câu 3.
%mO = 100% – %mC – %mH = 10,38%
Gọi công thức tổng quát của geraniol CxHyOz
Ta có tỉ lệ: x : y : z =$\frac{{77,92}}{{12}}:\frac{{11,7}}{1}:\frac{{10,38}}{{16}}$ = 6,49 : 11,7 : 0,649 = 10 : 18 : 1
CTĐGN của geraniol là C10H18O
Theo đề bài, phân tử geraniol có 1 nguyên tử oxygen
$ \Rightarrow $ CTPT của geraniol là C10H18O.