Đề thi học kỳ 1 Hóa 11 Cánh diều có đáp án-Đề 1 được soạn dưới dạng file word và PDF gồm 4 trang. Các bạn xem và tải về ở dưới.
I. PHẦN TRẮC NGHIỆM:
Câu 1. Phân tử khối của chất hữu cơ nào sau đây là 92 ?
A. $C{H_2}OH – CHOH – C{H_2}OH$.
B. ${C_4}{H_7} – N{H_2}$.
C. $HOC{H_2} – C{H_2}OH$.
D. ${C_2}{H_5} – CHO$.
Câu 2. Phương trình hóa học nào sau đây sai?
A. $N{H_4}HC{O_3}\xrightarrow{{{t^0}}}N{H_3} + C{O_2} + {H_2}O$.
B. $N{H_4}Cl\xrightarrow{{{t^0}}}N{H_3} + HCl$.
C. ${\left( {N{H_4}} \right)_2}C{O_3}\xrightarrow{{{t^0}}}2N{H_3} + C{O_2} + {H_2}O$.
D. $N{H_4}N{O_3}\xrightarrow{{{t^0}}}N{H_3} + HN{O_3}$.
Câu 3. Trong ammonia, nitrogen có số oxi hoá là
A. -3 .
B. +4 .
C. +5 .
D. +3 .
Câu 4. Ứng dụng nào sau đây không phải của $S{O_2}$ ?
A. Khử mùi không khí.
B. Tẩy trắng giấy, bột giấy.
C. Sản xuất sulfuric acid.
D. Tẩy màu dung dịch đường.
Câu 5. Trong hợp chất nitrogen có các mức oxi hoá (đặc trưng) nào sau đây?
A. $ – 3, + 3, + 5$.
B. $ – 3,0, + 3, + 5$.
C. $ – 3, + 1, + 2, + 3, + 4, + 5$.
D. $ – 3,0, + 1, + 2, + 3, + 4, + 5$.
Câu 6. Công thức phân tử không thể cho ta biết:
A. Tỉ lệ giữa các nguyên tố trong hợp chất
B. Hàm lượng mỗi nguyên tố trong hợp chất.
C. Cấu trúc phân tử hợp chất hữu cơ.
D. Số lượng các nguyên tố trong hợp chất.
Câu 7. Nung một hợp chất hữu cơ $X$ với lượng dư chất oxi hóa $CuO$, thấy thoát ra khí $C{O_2}$, hơi nước và khí ${N_2}$. Chọn kết luận đúng nhất.
A. X là hợp chất chứa 4 nguyên tố $C,H,N,O$.
B. X là hợp chất chỉ chứa 3 nguyên tố $C,H,N$.
C. $X$ luôn có chứa $C,H$ và có thể không có $N$.
D. $X$ chắc chắn chứa $C,H,N$ và có thể có oxi.
Câu 8. Tính chất nào sau đây không phải tính chất vật lí của sulfur ở điều kiện thường
A. Không tan trong nước.
B. Màu vàng.
C. Thể rắn.
D. Không tan trong benzene.
Câu 9. Trong dung dịch $NaHC{O_3}$ xảy ra các cân bằng sau:
$HCO_3^ – + {H_2}O \rightleftharpoons {H_2}C{O_3} + O{H^ – }$
$HCO_3^ – + {H_2}O \rightleftharpoons CO_3^{2 – } + {H_3}{O^ + }$
Phát biểu nào dưới đây là đúng ?
A. Cân bằng (1), (2) cho thấy ion $HCO_3^ – $là có tính chất lưỡng tính.
B. Trong phản ứng thuận của cân bằng $\left( 2 \right),{H_2}O$ đóng vai trò là acid.
C. Trong phản ứng thuận của cân bằng $\left( 2 \right),{H_2}O$ là chất cho ${H^ + }$.
D. Trong phản ứng thuận của phản ứng (1), ion $HCO_3^ – $đóng vai trò là acid.
Câu 10. Cân bằng hoá học là
A. một trạng thái cân bằng động vì khi hệ đạt cân bằng hoá học, phản ứng thuận vẫn xảy ra và phản ứng nghịch dừng lại.
B. một trạng thái cân bằng động vì khi hệ đạt cân bằng hoá học, phản ứng thuận dừng lại còn phản ứng nghịch vẫn xảy ra.
C. một trạng thái cân bằng động vì khi hệ đạt cân bằng hoá học, cả phản ứng thuận và phản ứng nghịch vẫn xảy ra.
D. một cân bằng tĩnh vì khi đó, $c$ phản ứng thuận và phản ứng nghịch đều dừng lại.
Câu 11. Hình dưới biểu thị sự phân li của acid có dạng $HX$ ( $X$ là các gốc acid khác nhau) trong nước. Phát biểu nào dưới đây không đúng?
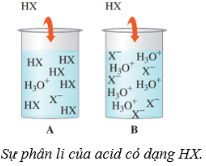
A. Dung dịch acid trong cốc $A$ là acid yếu.
B. Trong cốc $B$, acid $HX$ phân li hoàn toàn tạo ion ${H_3}{O^ + }$và ${X^ – }$.
C. Trong cốc $A$, acid HX phân li một phần thành các ion.
D. Dung dịch acid trong cốc $A$ có $pH$ thấp hơn $pH$ của cốc $B$.
Câu 12. Từ phổ $MS$ của benzene, người ta xác định được ion phân tử $\left[ {{C_6}{H_6}{\;^ + }} \right]$có giá trị $m/z$ bằng 78. Vậy, phân tử khối của benzene là
A. 77 .
B. 76 .
C. 78 .
D. 79 .
Câu 13. Tách chất màu thực phẩm thành những chất màu riêng thì dùng:
A. Phương pháp sắc kí.
B. Phương pháp chiết
C. Phương pháp kết tinh.
D. Phương pháp chưng cất.
Câu 14. Phát biểu nào dưới đây không đúng? Đặc điểm của ao, hồ có hiện tượng phú dưỡng là
A. Tảo xanh phát triển dày đặc trong nước.
B. Nước ao, hồ trong, các loại tảo phát triển chậm.
C. Màu nước đục, nước ao có màu xanh đen.
D. Rong, tảo trong ao, hồ phát triển mạnh.
Câu 15. Hình ảnh sơ đồ thí nghiệm dưới đây dùng để tách và tinh chế hợp chất hữu cơ theo phương pháp nào?
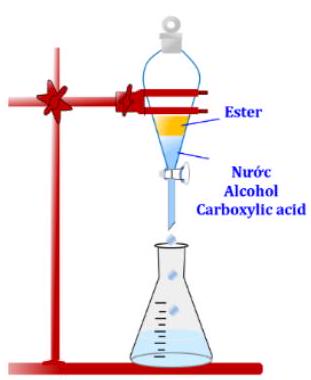 A. Sắc kí cột.
A. Sắc kí cột.
B. Kết tinh.
C. Chiết.
D. Chưng cất.
Câu 16. Nhận xét nào sau đây không đúng?
A. Khi đốt cháy các hợp chất hữu cơ đều thấy tạo $r{a_2}C{O_2}$
B. Đốt cháy hợp chất hữu cơ luôn thu được $C{O_2}$ và ${H_2}O$
C. Hợp chất hữu cơ có ở xung quanh ta
D. Hợp chất hữu cơ là hợp chất của Cacbon
Câu 17. Khí sulfur dioxide có mùi hắc, rất độc là tác nhân chủ yếu gây mưa acid. Công thức của khí sulfur dioxide là
A. $C{O_2}$.
B. $N{O_2}$.
C. NO.
D. $S{O_2}$.
Câu 18. Cho cân bằng hoá học sau: $2S{O_2}\left( g \right) + {O_2}\left( g \right)$ $2S{O_3}\left( g \right);{\Delta _r}H_{298}^o < 0$. Cho các biện pháp: (1) tăng nhiệt độ, (2) tăng áp suất chung của hệ phản ứng, (3) hạ nhiệt độ, (4) dùng thêm chất xúc tác ${V_2}{O_5}$, (5) giảm nồng độ $S{O_3}$, (6) giảm áp suất chung của hệ phản ứng. Những biện pháp nào làm cân bằng trên chuyển dịch theo chiều thuận?
A. (1), (2), (4), (5).
B. (2), (3), (5).
C. (2), (3), (4), (6).
D. (1), (2), (4).
Câu 19. Cho hỗn hợp các chất: A sôi ở ${36^ \circ }C,B$ sôi ở ${98^ \circ }C,C$ sôi ở ${126^ \circ }C,D$ sôi ở ${151^ \circ }C$. Có thể tách riêng các chất bằng cách nào?
A. Chiết
B. Thăng hoa
C. Chưng cất
D. Kết tinh
Câu 20. Ammonia là một nguyên liệu hóa học quan trọng. Phát biểu nào sau đây về tính chất của khí ammonia là sai?
A. Tan nhiều trong nước.
B. Không mùi.
C. Không màu.
D. Dễ hóa lỏng.
Câu 21. Cho sơ đồ chuyển hoá sau:

Biết, $X$ là đơn chất, $W$ là một acid mạnh, các chất $X,Y,G,Z,W$ cùng chứa một nguyên tố hoá học. $X$ có thể là
A. Nitrogen và sulfur.
B. Carbon và nitrogen.
C. Sulfur và carbon.
D. Chlorine và carbon.
Câu 22. Cấu hình electron thu gọn của sulfur là
A. $\left[ {Ne} \right]3\;{s^2}3{p^6}$.
B. $\left[ {He} \right]2\;{s^2}2{p^6}$.
C. $\left[ {Ne} \right]3\;{s^2}3{p^4}$.
D. $\left[ {He} \right]2\;{s^2}2{p^4}$.
Câu 23. Các dung dịch acid, base, muối dẫn điện được là do trong dung dịch của chúng có các
A. ion trái dấu.
B. anion (ion âm).
C. cation (ion dương).
D. chất.
Câu 24. Chất nào sau đây không thuộc loại chất hữu cơ?
A. $C{H_3}COONa$
B. $C{O_2}$
C. $C{H_4}$
D. $C{H_3}Cl$
Câu 25. Thể tích của 1,5 gam chất $X$ bằng thể tích của 0,8 gam khí oxygen (đo ở cùng điều kiện nhiệt độ, áp suất). Phân tử khối của X là
A. 120 .
B. 32 .
C. 60 .
D. 30 .
Câu 26. Trong số các khí sau: ${H_2},{O_2},N{H_3},C{l_2}$. Những khí có thể làm khô bằng sulfuric acid đặc là
A. ${H_2},{O_2},N{H_3}$.
B. $C{l_2},{O_2},N{H_3}$.
C. $N{H_3},C{l_2}$.
D. ${H_2},{O_2},C{l_2}$.
Câu 27. Phản ứng nào sau đây là phản ứng thuận nghịch ?
A. $2{H_2} + {O_2} \to 2{H_2}O$.
B. $Fe + 2HCl \to FeC{l_2} + {H_2}$.
C. ${H_2} + C{l_2} \to 2HCl$.
D. ${N_2} + 3{H_2} \rightleftharpoons 2N{H_3}$.
Câu 28. Tính chất vật lý chung của các chất hữu cơ là
A. Có nhiệt độ nóng chảy và nhiệt độ sôi cao, kém tan hoặc không tan trong nước.
B. Có nhiệt độ nóng chảy và nhiệt độ sôi thấp, ít tan hoặc không tan trong nước.
C. Có nhiệt độ nóng chảy cao và nhiệt độ sôi thấp, tan tốt trong nước.
D. Có nhiệt độ nóng chảy thấp và nhiệt độ sôi cao, tan tốt trong nước.
II. PHẦN TỰ LUẬN:
Câu 1. Phèn nhôm (hay phèn chua) có công thức $KAl{\left( {S{O_4}} \right)_2} \cdot 12{H_2}O$. Chất này được dùng làm trong nước có màu vàng phèn đục, nước ao hồ, sông ngòi (liều lượng 1 gam phèn chua cho 20 lít nước) hoặc khử rỉ sét trên kim loại hay làm chất cầm màu trong công nghiệp nhuộm, in. Giải thích tác dụng của phèn chua.
Câu 2. Trong công nghiệp người ta sản xuất sulfuric acid theo sơ đồ sau:
$Fe{S_2} \to S{O_2} \to S{O_3} \to {H_2}S{O_4}$
Người ta sử dụng 15 tấn quặng pirit sắt (chứa $80\% Fe{S_2}$ ) để sản xuất ra 39,2 tấn dung dịch ${H_2}S{O_4}40\% $. Tìm hiệu suất chung cho cả quá trình sản xuất sulfuric acid từ quặng trên.
Câu 3. Dioxin là chất độc hoá học mà quân đội Mỹ dùng nhiều trong chiến tranh với mục đích làm rụng lá cây rừng, trong đó nhiều nhất là ở Việt Nam. Phân tích nguyên tổ cho thấy dioxin có phần trăm khối lượng các nguyên tố $C,H$ và $Cl$ tương ứng là $44,72\% ;1,24\% ;44,10\% $, còn lại là oxygen. Phổ $MS$ của dioxin cho thấy chất này có phân tử khối là 322 . Xác định công thức phân tử của dioxin.
ĐÁP ÁN
I. PHẦN TRẮC NGHIỆM
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| A | D | A | A | C | C | D |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| D | A | C | D | C | A | B |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| C | B | D | B | C | B | A |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| C | A | B | C | D | D | B |
II. PHẦN TỰ LUẬN
Câu 1. Trong nước phèn chua phân li hoàn toàn theo phương trình điện li:
$KAl{\left( {S{O_4}} \right)_2} \cdot 12{H_2}O \to {K^ + } + A{l^{3 + }} + SO_4^{2 – } + 12{H_2}O$
Ion $A{l^{3 + }}$ bị thủy phân tạo $raAl{(OH)_3}$ ở dạng keo, có khả năng hấp thụ các chất rồi lắng xuống đáy bể hoặc gắn vào sợi vải cần nhuộm.
$A{l^{3 + }} + {H_2}O\;\overset {} \leftrightarrows Al{(OH)_3} + 3{H^ + }$
Câu 2. Ta có:
$ \Rightarrow {n_{Fe{S_2}}} = \frac{{15 \cdot {{10}^6} \cdot 80\% }}{{120}} = {10^5}\left( {\;mol} \right)$.
$ \Rightarrow {n_{{H_2}S{O_4}}} = {10^5} \cdot 2 \cdot H\% \,\,(mol)$
$ \Rightarrow {10^5} \cdot 2 \cdot H\% \; = \frac{{39,2 \cdot {{10}^6} \cdot 40}}{{100 \cdot 98}}$
$\; \Rightarrow H = 80\% $
Câu 3.
Gọi công thức tổng quát của dioxin là ${C_X}{H_y}{O_z}C{l_t}$
$\% \;{m_O} = 100 – 44,72 – 1,24 – 44,1 = 9,94\% $
Ta có: $x:y:z:t = $
$\frac{{44,72}}{{12}}:\frac{{1,24}}{1}:\frac{{9,94}}{{16}}:\frac{{44,10}}{{35,5}}$
$ = 3,73:1,24:0,62:1,24 = 6:2:1:2$
$ \Rightarrow $CTĐGN của dioxin là ${C_6}{H_2}OC{l_2}$
Công thức phân tử của aniline có dạng: ${\left( {{C_6}{H_2}OC{l_2}} \right)_n}$
${M_{dioxin\;}} = 161n = 322 \Rightarrow n = 2 \Rightarrow CTPT$ của dioxine là ${C_{12}}{H_4}{O_2}C{l_4}$