Trắc nghiệm Xác định đồng độ các chất-Hiệu suất phản ứng hóa 11 có đáp án được soạn dưới dạng file word gồm 5 trang. Các bạn xem và tải về ở dưới.
TRẮC NGHIỆM XÁC ĐỊNH ĐỒNG ĐỘ CÁC CHẤT – HIỆU SUẤT PHẢN ỨNG
I. LÝ THUYẾT CƠ BẢN
– Xét phản ứng thuận nghịch sau:
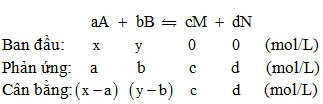
Khi phản ứng ở trạng thái cân bằng, ta có:
${K_C} = \frac{{C_C^c \cdot C_D^d}}{{C_A^a \cdot C_B^b}} \to C_B^b = \frac{{C_C^c \cdot C_D^d}}{{C_A^a \cdot {K_C}}}$
- Hiệu suất của phản ứng (giả sử tính theo chất $A$ ):
$H\% = \frac{a}{x} \cdot 100\% $
II. CÁC VÍ DỤ MINH HỌA
Câu 1. Người ta cho ${N_2}$ và ${H_2}$ vào trong bình kín dung tích không đổi và thực hiện phản ứng: ${N_2} + 3{H_2} \leftrightharpoons 2N{H_3}$. Sau một thời gian, nồng độ các chất trong bình như sau: $\left[ {{N_2}} \right] = $ $2M;\left[ {{H_2}} \right] = 3M;\left[ {N{H_3}} \right] = 2M$. Tính nồng độ $mol/l$ của ${N_2}$ và ${H_2}$ ban đầu.
Lời giải
Xét lượng ${N_2},{H_2}$ tham gia phản ứng:
- Nồng độ ${N_2}$ phản ứng = 1/2 nồng độ $N{H_3}$ sinh $ra = 1M$.
- Nồng độ ${H_2} = 3/2$ nồng độ $N{H_3}sinhra = 3M$.
$ \to $ Nồng độ ${N_2}$ ban đầu $ = 1 + 2 = 3M$, nồng độ ${H_2}$ ban đầu $ = 3 + 3 = 6M$.
Câu 2. Cho phản ứng hóa học: $CO\left( g \right) + C{l_2}\left( {g} \right) \leftrightharpoons COC{l_2}\left( {g} \right)$ có hệ số cân bằng ở t ${\;^ \circ }C$ là 4 . Biết rằng ở t ${\;^ \circ }C$ nồng độ cân bằng của $CO$ là $0,20mol/L$ và của $C{l_2}$ là $0,30mol/L$. Tính nồng độ cân bằng của $COC{l_2}$ ở t ${\;^ \circ }C$.
Lời giải
${K_C} = \frac{{\left[ {COC{l_2}} \right]}}{{\left[ {CO} \right] \cdot \left[ {C{l_2}} \right]}} = 4 \to \left[ {COC{l_2}} \right] = 4 \cdot 0,2 \cdot 0,3 = 0,024mol/L$.
Câu 3. Sử dụng chu trình kín trong tổng hợp ammonia, đun nóng hỗn hợp ${N_2}$ và ${H_2}$ ở một nhiệt độ nhất định xảy ra phản ứng thuận nghịch: ${N_2}\left( {g} \right) + 3{H_2}\left( {g} \right) \leftrightharpoons 2N{H_3}\left( {g} \right)$. Hệ đạt trạng thái cân bằng khi nồng độ của các chất như sau: $\left[ {{H_2}} \right] = 2,0mol/lít,\left[ {{N_2}} \right] = 0,01$ $mol/$ lít và $\left[ {N{H_3}} \right] = 0,4mol/$ lít. Tính hiệu suất của phản ứng tổng hợp $N{H_3}$.
Lời giải
Xét phản ứng: ${N_2} + 3{H_2} \leftrightharpoons 2N{H_3}$
Cân bằng: $0,01M$ $2M$ $0,4M$
Phản ứng: $x$ $3x$ $2x$
Ban đầu: $0,01 +x$ $2 + 3x$
$\left[ {N{H_3}} \right] = 2x = 0,4M \to x = 0,2M$.
Hiệu suất phản ứng tính theo ${N_2}$ (Ở trạng thái cân bằng $\left[ {{H_2}} \right]/\left[ {{N_2}} \right] > 3$ )
Nồng độ ${N_2}$ ban đầu $ = 0,01 + x = 0,21M$.
$H\% = \frac{{\left[ {{N_2}PU} \right]}}{{\left[ {{N_2}BD} \right]}} \cdot 100\% = \frac{{0,2}}{{0,21}} \cdot 100\% = 95,24\% $
III. BÀI TẬP TRẮC NGHIỆM
Câu 1. Biết rằng phản ứng ester hóa: $C{H_3}COOH + {C_2}{H_5}OH \leftrightharpoons C{H_3}COO{C_2}{H_5} + {H_2}O$ có ${K_C} = 4$. Cho nồng độ đầu của ${C_2}{H_5}OH$ là $1M,C{H_3}COOH$ là $2M$. Phần trăm ethanol bị este hóa là :
A. $80% $.
B. $68% $.
C. $75% $.
D. $84,5% $.
Câu 2. Cho biết phản ứng thuận nghịch sau: ${H_{2\left( {g} \right)}} + {I_{2\left( {g} \right)}} \leftrightharpoons 2H{I_{\left( g \right)}}$. Nồng độ ban đầu của ${H_2}$ và ${I_2}$ đều là $0,03mol/1$. Khi đạt đến cân bằng, nồng độ của $HI$ là $0,04mol/$. Nồng độ cân bằng của ${H_2}$ và ${I_2}$ là?
A. 0,07 .
B. 0,02 .
C. 0,01 .
D. 0,04 .
Câu 3. Khi phản ứng: ${H_{2\left( {g} \right)}} + {I_{2\left( {g} \right)}} \leftrightharpoons 2H{I_{\left( g \right)}}$ đạt đến trạng thái cân bằng thì hỗn hợp khí thu được có thành phần: 1,5 $molN{H_3},2mol{N_2}$ và $3mol{H_2}$. Vậy số mol ban đầu của ${H_2}$ là:
A. $3mol$.
B. $4mol$.
C. $5,25mol$.
D. $4,5mol$.
Câu 4. Hằng số cân bằng ${K_C}$ của phản ứng: ${H_2}\left( {g} \right) + B{r_2}\left( {g} \right) \rightleftharpoons 2HBr\left( g \right)$ ở ${730^ \circ }C$ là $2,{18.10^6}$. Cho 3,20 mol $HBr$ vào trong bình phản ứng dung tích 12,0 lít ở ${730^ \circ }C$. Tính nồng độ của ${H_2}$ ở trạng thái cân bằng?
A. $2,{7.10^{ – 4}}$.
B. $1,82 \cdot {10^{ – 4}}$.
C. $1,{57.10^{ – 4}}$.
D. $3,2 \cdot {10^{ – 4}}$.
Câu 5. Khi đung nóng $HI$ trong một bình kín, xảy ra phản ứng sau: $2HI\left( g \right) \leftrightharpoons {H_2}\left( {g} \right) + {I_2}$ (g). Ở một nhiệt độ $T$, hằng số ${K_C}$ của phản ứng trên là $1/64$. Hãy tính $% $ lượng $HI$ phân hủy ở nhiệt độ $T$ ?
A. $33,33% $.
B. $83,33% $.
C. $66,67% $.
D. $25% $.
Câu 6. Cho biết phản ứng sau: ${H_2}O\left( g \right) + CO\left( g \right) \rightleftharpoons {H_2}\left( {g} \right) + C{O_2}\left( {g} \right)$. Ở ${700^ \circ }C$ hằng số cân bằng ${K_C} = 1,873$. Nồng độ ${H_2}O$ ở trạng thái cân bằng là bao nhiêu, biết rằng hỗn hợp ban đầu gồm $0,300mol{H_2}O$ và $0,300molCO$ trong bình 10 lít ở ${700^ \circ }C$.
A. 0,042 .
B. 0,013 .
C. 0,017 .
D. 0,034 .
Câu 7. Cho phương trình phản ứng: $2A\left( {g} \right) + B\left( g \right) \leftrightharpoons 2X\left( g \right) + 2Y\left( g \right)$. Người ta trộn 4 chất, mỗi chất 1 mol vào bình kín dung tích 2 lít (không đổi). Khi cân bằng, lượng chất $X$ là 1,6 mol. Nồng độ chất $B$ ở trạng thái cân bằng là:
A. $0,7M$.
B. $0,8M$.
C. $0,35M$.
D. $0,5M$.
Câu 8. Cho phản ứng : $A + B \leftrightharpoons C$. Nồng độ ban đầu của $A$ là $0,12mol/l$; của $B$ là 0,1 $mol/L$. Sau 10 phút, nồng độ của $B$ giảm xuống còn $0,078mol/L$. Nồng độ còn lại của chất $A$ là:
A. 0,042 .
B. 0,098 .
C. 0,02 .
D. 0,034 .
Câu 9. Cho phản ứng: ${H_2}\left( {g} \right) + {I_2}\left( {g} \right) \leftrightharpoons 2HI\left( g \right)$. Ở nhiệt độ ${430^ \circ }C$ hằng số cân bằng ${K_C}$ của phản ứng trên bằng 53,96. Đun nóng một bình kín dung tích không đổi 10 lít chứa 4,0 gam ${H_2}$ và 406,4 gam ${I_2}$. Khi hệ phản ứng đạt trạng thái cân bằng ở ${430^ \circ }C$, nồng độ của $HI$ là:
A. $0,151M$.
B. $0,320M$.
C. $0,275M$.
D. $0,225M$.
Câu 10. Thực hiện phản ứng tổng hợp amoniac ${N_2} + 3{H_2} \leftrightharpoons 2N{H_3}$. Nồng độ mol ban đầu của các chất như sau : $\left[ {{N_2}} \right] = 1mol/l;\left[ {{H_2}} \right] = 1,2mol/l$. Khi phản ứng đạt cân bằng nồng độ $mol$ của $\left[ {N{H_3}} \right] = 0,2mol/l$. Hiệu suất của phản ứng là :
A. $43% $.
B. $10% $.
C. $30% $.
D. $25% $.
Câu 11. Iodine bị phân hủy bởi nhiệt theo phản ứng sau: ${I_2}\left( {g} \right) \leftrightharpoons 2I\left( g \right)$. Ở ${727^ \circ }C$ hằng số cân bằng của phản ứng ${K_C} = 3,80 \cdot {10^{ – 5}}$. Cho $0,0456mo{l_2}$ vào một bình kín dung dích 2,30 lít ở ${727^ \circ }C$. Tính nồng độ của ${I_2}$ ở trạng thái cân bằng?
A. $0,0194M$
B. $0,0086M$.
C. $0,0434M$.
D. $0,075M$.
Câu 12. Cho phản ứng : ${N_2} + {O_2} \leftrightharpoons 2NO$ có ${K_C} = 36$. Biết rằng nồng độ ban đầu của ${N_2}$ và ${O_2}$ đều bằng $0,01mol/l$. Hiệu suất của phản ứng tạo $NO$ là:
A. $75% $.
B. $80% $.
C. $50% $.
D. $40% $.
Câu 13. Cho phản ứng $RCOOH + R’OH \leftrightharpoons RCOOR’ $$ + {H_2}O$ có ${K_C} = 2,25$. Nếu ban đầu nồng độ mol của axit và ancol đều là $1M$ thì khi phản ứng đạt cân bằng bao nhiêu phần trăm ancol đã bị este hóa?
A. $75% $.
B. $50% $.
C. $60% $.
D. $65% $.
Câu 14. Ở một nhiệt độ nhất định, phản ứng thuận nghịch ${N_2}\left( {g} \right) + 3{H_2}\left( {g} \right) \leftrightharpoons 2N{H_3}\left( {g} \right)$ đạt trạng thái cân bằng khi nồng độ của các chất như sau: $\left[ {{H_2}} \right] = 2,0mol/lít$. $\left[ {{N_2}} \right] = 0,01mol/lit$. $\left[ {N{H_3}} \right] = 0,4mol/lít$. Nồng độ ban đầu của ${H_2}$ là:
A. $2,6M$.
B. $4,6M$.
C. 3,6 M.
D. $5,6M$.
Câu 15. Cho 5,6 gam $CO$ và 5,4 gam ${H_2}O$ vào một bình kín dung tích không đổi 10 lít. Nung nóng bình một thời gian ở ${830^ \circ }C$ để hệ đạt đến trạng thái cân bằng: $CO\left( g \right) + {H_2}O\left( g \right)$ $ \rightleftarrows C{O_2}\left( {g} \right) + {H_2}\left( {g} \right)$; (hằng số cân bằng ${K_C} = 1$ ). Nồng độ cân bằng của $CO,{H_2}O$ lần lượt là
A. $0,08M$ và $0,18M$.
B. $0,018M$ và $0,008M$.
C. $0,012M$ và $0,024M$.
D. $0,008M$ và $0,018M$.
Câu 16. Cho phản ứng: ${H_{2\left( {g} \right)}} + {I_{2\left( {g} \right)}} \leftrightharpoons 2HI\left( g \right)$. Ở nhiệt độ ${t^ \circ }C$, hằng số cân bằng ${K_C}$ của phản ứng trên bằng 100. Đun nóng một bình kín dung tích không đổi 10 lít chứa 5,0 gam ${H_2}$ và 457,2 gam ${I_2}$. Khi hệ phản ứng đạt trạng thái cân bằng ở t ${\;^ \circ }C$, nồng độ của $HI$ là
A. $0,334M$.
B. $0,167M$.
C. $0,225M$.
D. $0,151M$.
Câu 17. Ở ${25^ \circ }C$ hằng số cân bằng của phản ứng: $C{H_3}COOH + {C_2}{H_5}OH \leftrightharpoons C{H_3}COO{C_2}{H_5}$ $ + {H_2}O$ là ${K_C} = 4$. Biết nồng độ ban đầu của $C{H_3}COOH$ bằng $1M$. Khi phản ứng đạt trạng thái cân bằng thì nồng độ của $C{H_3}COO{C_2}{H_5}$ là $0,93M$. Nồng độ ban đầu của ${C_2}{H_5}OH$ là
A. $1M$.
B. $2/3M$.
C. $2M$.
D. $4M$.
Câu 18. Xét cân bằng phản ứng $C{l_2}\left( {g} \right) + {H_2}\left( {g} \right) \leftrightharpoons 2HCl\left( g \right)$.Ở nhiệt độ $T$ hằng số cân bằng của phản ứng là 0,8 và nồng độ tại thời điểm cân bằng của $HCl$ là $0,2M$. Biết nồng độ ban đầu của ${H_2}$ gấp 3 lần nồng độ ban đầu của $C{l_2}$. Vậy nồng độ ban đầu của ${H_2}$ và $C{l_2}$ lần lượt là
A. $0,3M$ và $0,1M$.
B. $0,6M$ và $0,2M$.
C. $0,3M$ và $0,9M$.
D. $1,2M$ và $0,4M$.
Câu 19. Cho biết hằng số cân bằng của phản ứng ester hóa: $RCOOH + R$’ $OH \leftrightharpoons RCOOR$’ $ + {H_2}O$ có giá trị bằng 4 . Nếu cho hỗn hợp cùng số mol acid và alcol tác dụng với nhau thì khi phản ứng ester hóa đạt tới trạng thái cân bằng thì có bao nhiêu $% $ alcol và acid đã bị ester hóa?
A. $50% $.
B. $66,7% $.
C. $75% $.
D. $62,5% $.
Câu 20. Cho cân bằng: $CO\left( g \right) + {H_2}O\left( g \right) \leftrightharpoons C{O_2}\left( {g} \right) + {H_2}\left( {g} \right)$
Biết rằng ở ${t^ \circ }C$ lúc đầu chỉ có $CO$ và hơi nước với nồng độ $\left[ {CO} \right] = 0,1M,\left[ {{H_2}O} \right] = 0,4M$. ${K_C} = 1$. Nồng độ cân bằng của $C{O_2}$ ở ${t^ \circ }C$ là
A. 0,08 .
B. 0,06
C. 0,05
D. 0,1
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 |
|
D |
C | C | B | C |
| 6 | 7 | 8 | 9 |
10 |
| B | C | B | C |
D |
|
11 |
12 | 13 | 14 | 15 |
| A | A | C | A |
D |
|
16 |
17 | 18 | 19 | 20 |
| A | D | B | B |
A |