Đề kiểm tra học kỳ 1 Hóa 11 Chân trời sáng tạo có đáp án-Đề 2 được soạn dưới dạng file word và PDF gồm 4 trang. Các bạn xem và tải về ở dưới.
I. PHẦN TRẮC NGHIỆM:
Câu 1. Theo thuyết cấu tạo hóa học, trong phân tử các chất hữu cơ, các nguyên tử liên kết với nhau
A. theo đúng số oxygen hóa
B. theo đúng hóa trị
C. theo một thứ tự nhất định
D. theo đúng hóa trị và theo một thứ tự nhất định
Câu 2. Kim loại bị thụ động trong dung dịch ${H_2}S{O_4}$ đặc, nguội là
A. $Cu,Ag$.
B. $Al,Fe$.
C. $Fe,Ag$.
D. $Au,Pt$.
Câu 3. Phản ứng nào sau đây nitrogen thể hiện tính khử?
A. ${N_2} + {O_2}\xrightarrow{{{t^0}}}2NO$
B. ${N_2} + 3{H_2}$ $\xrightarrow{{{t^0}}}$ $N{H_3}$
C. ${N_2} + 6Li\xrightarrow{{{t^0}}}2L{i_3}\;N$
D. ${N_2} + 3Ca\xrightarrow{{{t^0}}}C{a_3}\;{N_2}$
Câu 4. Sau khi chưng cất cây sả bằng hơi nước, người ta dùng phương pháp chiết để tách riêng lớp tinh dầu ra khỏi nước. Phát biểu không đúng là
A. Có thể dùng phễu chiết để tách riêng lớp tinh dầu khỏi nước.
B. Tinh dầu có khối lượng riêng nặng hơn nước nên nằm phía dưới.
C. Dùng phương pháp chiết lỏng – lỏng để tách riêng lớp tinh dầu ra khỏi nước.
D. Hỗn hợp thu được tách thành hai lớp.
Câu 5. Sự chuyển dịch cân bằng là
A. Phản ứng trực tiếp theo chiều thuận .
B. Phản ứng trực tiếp theo chiều nghịch.
C. Chuyển từ trạng thái cân bằng này thành trạng thái cân bằng khác.
D. Phản ứng tiếp tục xảy ra cả chiều thuận và chiều nghịch.
Câu 6. Công thức phân tử của ammonia là
A. $N{H_2}$.
B. $N{H_5}$.
C. $N{H_3}$.
D. $N{H_4}$.
Câu 7. Chất nào sau đây nhiệt phân không thu được khí $N{H_3}$ ?
A. $N{H_4}N{O_3}$.
B. $N{H_4}HC{O_3}$.
C. ${\left( {N{H_4}} \right)_2}C{O_3}$.
D. $N{H_4}Cl$.
Câu 8. Cho phương trình hoá học: ${N_2}\,(g) + {O_2}\,(g)\rightleftharpoons 2NO\,(g)$, ${\Delta _r}H_{298}^0 > 0$
Hãy cho biết cặp yếu tố nào sau đây đều ảnh hưởng đến sự chuyển dịch cân bằng hoá học trên ?
A. Nồng độ và chất xúc tác
C. Nhiệt độ và nồng độ.
B. Chất xúc tác và nhiệt độ.
D. Áp suất và nồng độ.
Câu 9. Thuộc tính nào sau đây không phải là của các hợp chất hữu cơ ?
A. Dễ bay hơi và dễ cháy hơn trong hợp chất vô cơ.
B. Khả năng phản ứng hoá học chậm theo chiều hướng khác nhau
C. Liên kết hoá học trong hợp chất hữu cơ thường là liên kết ion.
D. Không bền ở nhiệt độ cao
Câu 10. Cho sơ đồ: $\left( X \right) + HN{O_3} \to Fe{\left( {N{O_3}} \right)_3} + {H_2}O$.
Chất $\left( X \right)$ trong sơ đồ là
A. Fe.
B. $Fe{(OH)_3}$.
C. $Fe{(OH)_2}$.
D. $FeO$.
Câu 11. Chất nào sau đây thuộc loại chất điện li mạnh?
A. $C{H_3}COOH$.
B. ${C_2}{H_5}OH$.
C. ${H_2}O$.
D. $NaCl$.
Câu 12. Cho biết phổ khối lượng của benzaldehyde như sau:
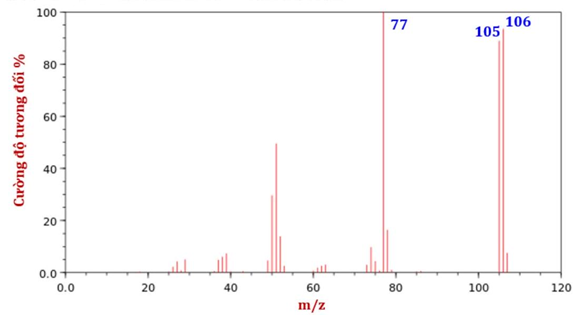
Phân tử khối của benzaldehyde là
A. 50 .
B. 105 .
C. 77 .
D. 106 .
Câu 13. Hóa chất được sử dụng để phân biệt dung dịch ${H_2}S{O_4}$ loãng và $HCl$ loãng là
A. $NaN{O_3}$.
B. $Ba{\left( {N{O_3}} \right)_2}$.
C. $Fe{\left( {N{O_3}} \right)_3}$.
D. $Cu{\left( {N{O_3}} \right)_2}$.
Câu 14. Để đảm bảo an toàn cho việc vận chuyển và tiêu thụ khí thiên nhiên, một lượng khí $X$ ở áp suất $1,1MPa$ được bơm trước vào đường ống dẫn khí của một số đoạn đường để làm khí bảo vệ. Vậy khí X là
A. Chlorine.
B. Hydrogen.
C. Oxygen.
D. Nitrogen.
Câu 15. Phương trình điện li viết đúng là
A. $C{H_3}COOH \to C{H_3}CO{O^ – } + {H^ + }$.
B. $NaCl \to N{a^{2 + }} + C{l^{2 – }}$.
C. $Ca{(OH)_2} \to C{a^{2 + }} + 2O{H^ – }$.
D. ${C_2}{H_5}OH \to {C_2}H_5^ + + O{H^ – }$.
Câu 16. Có bao nhiêu chất thuộc loại hydrocarbon trong dãy sau : (1) $C{H_2} = CH – Cl$; (2) $C{H_3} – C{H_(}{\left( {C{H_3}} \right)_2}$; (3) $HCHO$; (4) ${C_2}{H_5}Br$; (5) $C{H_3}COOH$; (6) ${C_6}{H_6}$ ?
A. 2
B. 1
C. 4
D. 3
Câu 17. Để xác định phân tử khối của hợp chất hữu cơ, người ta sử dụng phổ khối lượng MS, trong đó phân tử khối của chất là giá trị $m/z$ của
A. peak có cường độ tương đối (%) lớn nhất.
B. peak $\left[ {{M^ + }} \right]$lớn nhất.
C. peak $\left[ {{M^ + }} \right]$nhỏ nhất.
D. peak xuất hiện nhiều nhất.
Câu 18. Chất phản ứng với bột $S$ ở điều kiện thường là
A. ${H_2}$.
B. ${O_2}$.
C. Hg.
D. Fe.
Câu 19. Hợp chất hữu cơ dưới đây thể hiện tính chất đặc trưng của nhóm chức nào ?
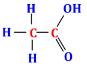
A. aldehyde.
B. ester.
C. alcohol.
D.carboxylic acid.
Câu 20. Cặp hợp chất hữu cơ nào sau đây là đồng phân của nhau?
A. $C{H_3} – CO – C{H_3}$ và $C{H_3} – C{H_2} – OH$
B. $C{H_3} – O – C{H_3}$ và ${C_2}{H_5}OH$.
C. $C{H_3}OH$ và ${C_2}{H_5}OH$.
D. $C{H_3} – CO – C{H_3}$ và $C{H_3} – O – C{H_3}$
Câu 21. Dãy chất sau đây gồm những chất đều tác dụng được với dung dịch ${H_2}S{O_4}$ loãng là
A. $Mg,ZnO,Ba{(OH)_2},CaC{O_3}$.
B. $CuO,Fe{(OH)_2},Al,NaCl$.
C. $Cu,ZnO,NaOH,MgC{l_2}$.
D. $Na,CaC{O_3},Mg{(OH)_2},BaS{O_4}$.
Câu 22. Tiến hành đo $pH$ của dung dịch $X$ thấy giá trị $pH = 9$. Phát biểu nào dưới đây không đúng ?
A. Dung dịch $X$ làm phenolphtalein chuyển sang màu hồng.
B. Dung dịch $X$ có môi trường kiềm.
C. Dung dịch $X$ là một có $\left[ {{H^ + }} \right] < {10^{ – 7}}M$.
D. Dung dịch $X$ là một acid mạnh.
Câu 23. Cho các phản ứng:
(1) ${H_2}\left( g \right) + {I_2}\left( g \right)$$\xrightarrow{{}}$$2HI\left( g \right)$
(2) $2S{O_2}\left( g \right) + {O_2}\left( g \right)$ $\xrightarrow{{}}$ $2S{O_3}\left( g \right)$
(3) $3{H_2}\left( g \right) + {N_2}\left( g \right)$ $\xrightarrow{{}}$ $2N{H_3}\left( g \right)$
(4) ${N_2}{O_4}\left( g \right)$ $\xrightarrow{{}}$ $2N{O_2}\left( g \right)$
Các phản ứng chuyển dịch theo chiều nghịch khi ta giảm áp suất của hệ là :
A. (1), (2).
B. (2), (4).
C. (3), (4).
D. (2), (3).
Câu 24. Một ống nghiệm chứa đầy chất khí $X$, úp ngược ống nghiệm rồi cho nhanh vào chậu chứa đầy nước, kết quả thấy khí $X$ hầu như không tan vào nước:
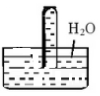
Chất khí X trong ống nghiệm là
A. ${N_2}$.
B. $N{H_3}$.
C. $C{O_2}$.
D. $S{O_2}$.
Câu 25. Công thức phân tử của chất $Y$ có công thức cấu tạo dạng khung phân tử như sau là
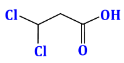
A. ${C_3}{H_4}{O_2}C{l_2}$.
B. ${C_3}{H_5}{O_2}C{l_2}$.
C. ${C_2}{H_5}{O_2}C{l_2}$.
D. ${C_3}{H_3}{O_2}C{l_2}$.
Câu 26. Các chất nào sau đây thuộc dãy đồng đẳng có công thức chung ${C_n}{H_2}n + 2$ ?
A. ${C_2}{H_6},{C_3}{H_8},{C_4}{H_8},{C_5}{H_{12}}$.
B. $C{H_4},{C_2}{H_4},{C_3}{H_4},{C_4}{H_4}$.
C. $C{H_4},{C_2}{H_6},{C_4}{H_{10}},{C_5}{H_{12}}$.
D. ${C_2}{H_4},{C_3}{H_6},{C_4}{H_8},{C_5}{H_{10}}$.
Câu 27. $C{O_2}$ có lẫn $S{O_2}$. Trong các hóa chất sau: dung dịch $NaOH$; dung dịch $B{r_2}$; dung dịch $KMn{O_4}$; dung dịch ${H_2}\;S$; nước vôi trong. Hãy cho biết có bao nhiêu hóa chất có thể sử dụng để loại bỏ $S{O_2}$ ?
A. 2 .
B. 3 .
C. 5 .
D. 4 .
Câu 28. Phương pháp tách biệt và tinh chế nào sau đây được ứng dụng để ngâm hoa quả làm siro?
A. Chiết.
B. Chưng cất.
C. Sắc kí cột.
D. Kết tinh.
II. PHẦN TỰ LUẬN:
Câu 1. (1 điểm)
Khí $S{O_2}$ do các nhà máy thải ra là một trong những nguyên nhân quan trọng gây ô nhiễm không khí. Tiêu chuẩn quốc tế quy định: Nếu trong không khí nồng độ $S{O_2}$ vượt quá 30.10-6 $mol/m3$ thì không khí bị ô nhiễm $S{O_2}$. Khi tiến hành phân tích 40 lít không khí ở một thành phố A thấy có chứa $0,084mgS{O_2}$, thành phố $B$ có chứa $0,0035mgS{O_2}$. Hãy cho biết thành phố nào bị ô oniễm $S{O_2}$ ?
Câu 2. (1 điểm)
Hấp thụ hoàn toàn 2,9748 lít khí $S{O_2}$ (ở đac) vào 2,5 lít dung dịch $Ba{(OH)_2}$ nồng độ a $mol/1$, thu được 17,36 gam kết tủa. Xác định giá trị của a.
Câu 3. (1 điểm)
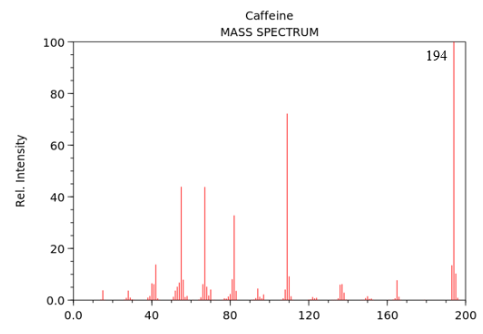
Caffeine là chất kích thích tự nhiên được tìm thấy trong cây trà, cà phê và cacao. Chúng hoạt động bằng cách kích thích não và hệ thần kinh trung ương, giúp con người tỉnh táo và ngăn ngừa sự mệt mỏi. Thành phần phần trăm về khối lượng của các nguyên tố trong phân tử caffeine như sau: $49,48\% C;5,15\% H$; $16,49\% O;28,87\% \;N$. Phổ MS của caffeine được cho như hình dưới đây. Xác định công thức phân tử của caffeine.
ĐÁP ÁN VÀ LỜI GIẢI
I. PHẦN TRẮC NGHIỆM
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| D | B | A | B | C | C | A |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| C | C | B | D | D | B | D |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| C | A | B | C | D | B | A |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| D | D | A | A | C | B | A |
II.PHẦN TỰ LUẬN
Câu 1.
Nồng độ $S{O_2}$ trong không khí thành phố $A$ là:
$\;\frac{{0,084 \cdot {{10}^{ – 3}}:64}}{{40:{{10}^3}}} = 3,28.1$
Nồng độ $S{O_2}$ trong không khí thành phố $B$ là:
$\;\frac{{0,0035 \cdot {{10}^{ – 3}}:64}}{{40:{{10}^3}}} = 1,37.1Cmol/{m^3}$
Theo tiêu chuẩn thì thành phố A bị ô nhiễm $S{O_2}$.
Câu 2.
Ta có: ${n_{S{O_2}}} = 0,12$ mol; ${n_{BaS{O_3}}} = 0,08\;mol$
$ \Rightarrow {n_{SO_3^{2 – }}} = {n_{BaS{O_3}}} = 0,08\;mol < {n_{S{O_2}}} \Rightarrow \;$tạo hai muối $BaS{O_3}$ và $Ba{\left( {HS{O_3}} \right)_2}$
Phương trình phản ứng:
$Ba{(OH)_2} + S{O_2} \to BaS{O_3} \downarrow + {H_2}O$
$x… \ldots \ldots \ldots x….. \ldots …x$
$Ba{(OH)_2} + 2S{O_2} \to Ba{\left( {HS{O_3}} \right)_2}$
$y \ldots \ldots \ldots \ldots \ldots ..2y \ldots \ldots \ldots ..y$
Ta có: $\left\{ {\begin{array}{*{20}{l}}
{x + 2y = 0,12} \\
{x = 0,08}
\end{array} \Leftrightarrow \left\{ {\begin{array}{*{20}{l}}
{x = 0,08} \\
{y = 0,02}
\end{array}} \right.} \right.$
$ \Rightarrow {n_{Ba{{(OH)}_2}}} = x + y = 0,1 \Rightarrow {n_{Ba{{(OH)}_2}}} = 2,5.a$
Ta có: $2,5a = 0,1 \Rightarrow a = 0,04\left( {\;mol/l} \right)$
Câu 3.
Gọi công thức tổng quát của caffeine là ${C_X}{H_y}{O_z}{N_t}$
Ta có: $x:y:z:t$
$ = \frac{{49,48}}{{12}}:\frac{{5,15}}{1}:\frac{{16,49}}{{16}}:\frac{{28,87}}{{14}}$
$ = 4,12:5,15:1,03:2,06 = 4:5:1:2$
$ \Rightarrow $ CTĐGN của caffeine là ${C_4}{H_5}O{N_2}$
CTPT của caffeine có dạng: ${\left( {{C_4}{H_5}O{N_2}} \right)_n}$
Theo phổ MS ta có ${M_{caffeine\;}} = 194 \Rightarrow 97n = 194 \Rightarrow n = 2$
$ \Rightarrow $CTPT của caffeine: ${C_8}{H_{10}}{O_2}\;{N_4}$