Đề kiểm tra học kỳ 1 Hóa 11 Cánh diều có đáp án-Đề 2 được soạn dưới dạng file word và PDF gồm 4 trang. Các bạn xem và tải về ở dưới.
I. PHẦN TRẮC NGHIỆM:
Câu 1. Phổ khối lượng của hợp chất hữu cơ $X$ thu được như hình vẽ:
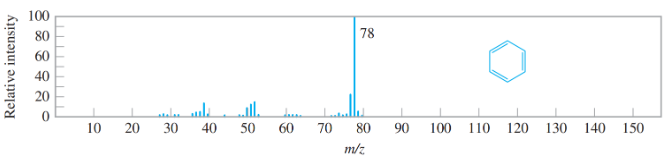
Phân tử khối của hợp chất hữu cơ X là
A. 50 .
B. 80 .
C. 78 .
D. 76 .
Câu 2. Cho cân bằng hoá học: ${N_2}\left( {\;g} \right) + 3{H_2}\left( {\;g} \right)$ $ \rightleftharpoons $ $2N{H_3}\left( {\;g} \right)$; phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi
A. thêm chất xúc tác $Fe$.
B. thay đổi nồng độ ${N_2}$.
C. thay đổi nhiệt độ.
D. thay đổi áp suất của hệ.
Câu 3. Tác nhân chủ yếu gây mưa axit là
A. $CO$ và $C{H_4}$.
B. $C{H_4}$ và $N{H_3}$.
C. $S{O_2}$ và $N{O_2}$.
D. $CO$ và $C{O_2}$.
Câu 4. Hợp chất nào sau đây của nitrogen không được tạo ra khi cho $HN{O_3}$ tác dụng với kim loại?
A. $NO$
B. $N{H_4}N{O_3}$
C. $N{O_2}$
D. ${N_2}{O_5}$
Câu 5. Hấp phụ là quá trình xảy ra khi
A. chất $A$ bị chất rắn $B$ thay đổi trạng thái tồn tại từ lỏng sang khí.
B. chất $A$ hoà tan vào dung môi tốt hơn nhờ chất rắn
C. chất $A$ bị giữ lại bên trong chất rắn $B$ làm tăng nồng độ chất $A$ bên trong chất rắn
D. chất $A$ bị giữ lại trên bề mặt chất rắn $B$.
Câu 6. Khi làm thí nghiệm với ${H_2}S{O_4}$ đặc, nóng thường sinh ra khí $S{O_2}$. Để hạn chế tốt nhất khí $S{O_2}$ thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây?
A. Giấm ăn.
B. Muối ăn.
C. Cồn.
D. Nước vôi trong.
Câu 7. Hợp chất $Z$ có công thức đơn giản nhất là $C{H_2}Cl$ và có tỉ khối hơi so với helium bằng 24,75 . Công thức phân tử của $Z$ là
A. ${C_2}{H_6}Cl$.
B. ${C_3}{H_9}C{l_3}$.
C. $C{H_2}Cl$.
D. ${C_2}{H_4}C{l_2}$.
Câu 8. Nitric acid đặc, nóng phản ứng được với tất cả các chất trong nhóm nào sau đây?
A. $CaO,N{H_3},Au,FeC{l_2}$
B. $Mg{(OH)_2},CuO,N{H_3},Pt$
C. $Mg{(OH)_2},N{H_3},C{O_2},Au$
D. $Mg{(OH)_2},CuO,N{H_3},Ag$
Câu 9. Nitrogen có những đặc điểm về tính chất như sau:
a) Nguyên tử nitrogen có 5 electron ở lớp ngoài cùng nên chỉ có khả năng tạo hợp chất cộng hóa trị trong đó nitrogen có số oxi hóa +5 và -3 .
b) Khí nitrogen tương đối trơ ở nhiệt độ thường.
c) Nitrogen là phi kim hoạt động ở nhiệt độ cao.
d) Nitrogen thể hiện tính oxi hóa khi tác dụng với kim loại mạnh và hydrogen.
e) Nitrogen thể hiện tính khử khi tác dụng với nguyên tố có độ âm điện lớn hơn.
Số phát biểu đúng là:
A. a, d, e.
B. $a,c,d$.
C. $a,b,c$.
D. $b,c,d,e$.
Câu 10. Chất nào sau đây thuộc loại hợp chất hữu cơ?
A. ${K_2}C{O_3}$
B. $C{O_2}$
C. $C{H_4}$
D. $CO$
Câu 11. Phát biểu nào sau đây là đúng về công thức đơn giản nhất của hợp chất hữu cơ ?
A. Công thức biểu thị tỉ lệ phần trăm số mol của mỗi nguyên tố trong phân tử.
B. Công thức biểu thị tỉ lệ số nguyên tử $C$ và $H$ có trong phân tử.
C. Công thức biểu thị số nguyên tử của mỗi nguyên tố trong phân tử.
D. Công thức biểu thị tỉ lệ tối giản về số nguyên tử của các nguyên tố trong phân tử.
Câu 12. Phân tử chất hữu cơ $X$ có 2 nguyên tố $C,H$. Tỉ khối hơi của $X$ so với ${H_2}$ là 21 . Công thức phân tử của $X$ là
A. ${C_3}{H_6}$
B. ${C_6}{H_6}$
C. ${C_4}{H_8}$
D. ${C_3}{H_8}$
Câu 13. Cho $FeC{O_3}$ tác dụng với ${H_2}S{O_4}$ đặc nóng, sản phẩm khí thu được là
A. ${H_2}\;S$
B. $S{O_3}$ và $C{O_2}$
C. $S{O_2}$ và $C{O_2}$
D. $S{O_2}$ và $CO$
Câu 14. Yếu tố không làm chuyển dịch cân bằng hóa học là
A. nồng độ.
B. chất xúc tác.
C. áp suất.
D. nhiệt độ.
Câu 15. Cấu hình electron của nguyên tử của sulfur $\left( {Z = 16} \right)$ là
A. $1{s^2}2{s^2}2{p^6}3{s^2}3{p^4}$.
B. $1\;{s^2}2\;{s^2}2{p^5}$.
C. $1\;{s^2}2\;{s^2}2{p^6}3\;{s^2}3{p^2}$.
D. $1\;{s^2}2\;{s^2}2{p^1}$.
Câu 16. Cho các dung dịch muối: $N{a_2}C{O_3}$ (1), $NaN{O_3}$ (2), $NaN{O_2}$ (3), $NaCl$ (4), $N{a_2}S{O_4}$ (5), $C{H_3}COONa\left( 6 \right),N{H_4}HS{O_4}$ (7), $N{a_2}\;S\left( 8 \right)$. Những dung dịch muối làm quỳ hoá xanh là
A. (1), (3), (5), (6).
B. (1), (3), (6), (8).
C. (2), (5), (6), (7)
D. (1), (2), (3), (4).
Câu 17. Có bao nhiêu cách chiết?
A. 2
B. 3
C. 4
D. 1
Câu 18. Cho phương trình: $N{H_3} + {H_2}O\;$$ \rightleftharpoons $$N{H_4}{\;^ + } + O{H^ – }$
Trong phản ứng thuận, theo thuyết Bronsted – Lowry chất nào là base?
A. $O{H^ – }$.
B. $N{H_3}$.
C. ${H_2}O$.
D. $N{H_4}{\;^ + }$.
Câu 19. Ion đóng vai trò acid trong nước là
A. $NH_4^ + $.
B. ${K^ + }$.
C. $HCO_3^ – $.
D. $C{H_3}CO{O^ – }$.
Câu 20. Chất có tính chất lưỡng tính là
A. $NaHC{O_3}$.
B. $NaCl$.
C. $HCl$.
D. $NaOH$.
Câu 21. Khí $C{O_2}$ có lẫn tạp chất là $S{O_2}$. Để loại bỏ tạp chất thì cần sục hỗn hợp vào dung dịch nào sau đây?
A. Dung dịch $NaOH$ dư.
B. Dung dịch $B{r_2}$ dư.
C. Dung dịch $Ba{(OH)_2}$ dư.
D. Dung dịch $Ca{(OH)_2}$ dư.
Câu 22. Vitamin $A$ (retinol) có công thức phân tử ${C_{20}}{H_{30}}O$, công thức đơn giản nhất của vitamin $A$ là
A. ${C_2}{H_3}O$.
B. ${C_{20}}{H_{30}}O$.
C. ${C_4}{H_6}O$.
D. ${C_4}{H_6}{O_2}$.
Câu 23. Cho các cân bằng sau:
(1) $2S{O_2}\left( {\;g} \right) + {O_2}\left( {\;g} \right)\mathop \rightleftarrows \limits^{xt,{t^ \circ }} 2S{O_3}\left( {\;g} \right)$
(2) ${N_2}\left( {\;g} \right) + 3{H_2}\left( {\;g} \right)\mathop \rightleftarrows \limits^{xt{t^ \circ }} 2N{H_3}\left( {\;g} \right)$
(3) $C{O_2}\left( {\;g} \right) + {H_2}\left( {\;g} \right)\mathop \rightleftarrows \limits^{{t^ \circ }} CO\left( g \right) + {H_2}O\left( g \right)$
(4) $2HI\left( g \right)\mathop \rightleftarrows \limits^{{t^ \circ }} {H_2}\left( {\;g} \right) + {I_2}\left( {\;g} \right)$
Khi thay đổi áp suất, nhóm gồm các cân bằng hóa học đều không bị chuyển dịch là
A. (1) và (3).
B. (2) và (4).
C. (3) và (4).
D. (1) và (2).
Câu 24. Trong công nghiệp, để điều chế khí than ướt, người ta thổi hơi nước qua than đá đang nóng đỏ. Phản ứng hoá học xảy ra như sau
$C\left( s \right) + {H_2}O\left( g \right) \rightleftharpoons CO\left( g \right) + {H_2}\left( {\;g} \right),\,{\Delta _r}H = 131\;kJ$
Điều khẳng định nào sau đây là đúng?
A. Tăng nồng độ hydrogen làm cân bằng chuyển sang chiều thuận.
B. Tăng áp suất chung của hệ làm cân bằng không thay đổi.
C. Tăng nhiệt độ của hệ làm cân bằng chuyển sang chiều thuận.
D. Dùng chất xúc tác làm cân bằng chuyển sang chiều thuận.
Câu 25. Trong nhiệt kế chứa thủy ngân rất độc. Khi nhiệt kế bị vỡ người ta thường dùng chất nào sau đây để thu hồi thủy ngân là tốt nhất?
A. Cát.
B. Sulfur.
C. Than.
D. Muối ăn.
Câu 26. Dựa vào thành phần phân tử, hợp chất hữu cơ được chia thành mấy loại chính?
A. 4
B. 1
C. 2
D. 3
Câu 27. Dựa vào phổ hồng ngoại (IR) của hợp chất $X$ có công thức $C{H_3}CH\left( {OH} \right)C{H_3}$ dưới đây, hãy chỉ ra peak nào giúp dự đoán $X$ có nhóm – $OH$ ?
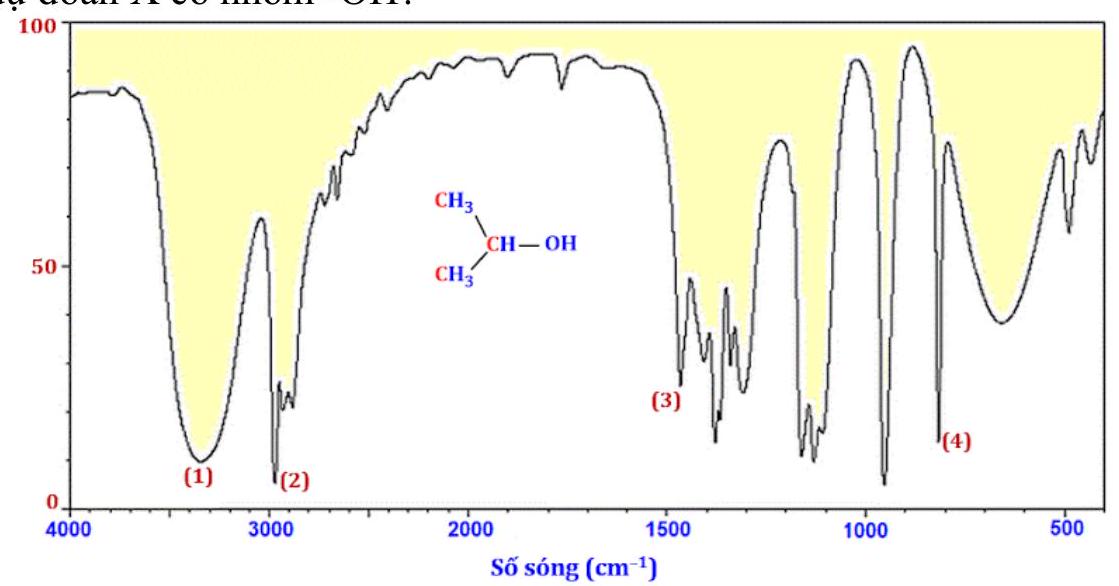
A. (1).
B. (2).
C. (3).
D. (4).
Câu 28. Cho hình vẽ của bộ dụng cụ chưng cất thường:
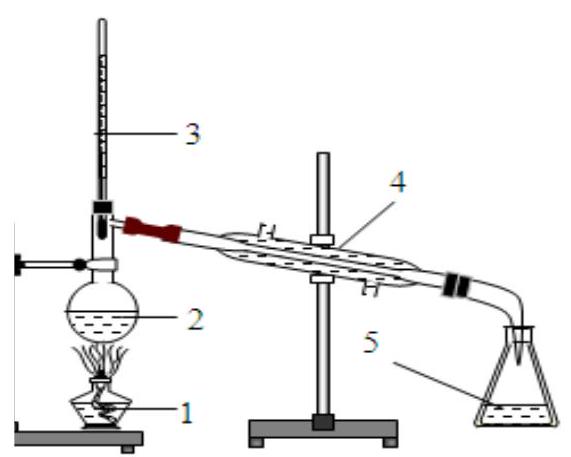
Tên các chi tiết ứng với các chũ̃ số trong hình vẽ trên là
A. 1 – Nhiệt kế, 2 – đèn cồn, 3 – bình cầu có nhánh, 4 – sinh hàn, 5 – bình hứng (erlen).
B. 1 – Đèn cồn, 2 – bình cầu có nhánh, 3 – nhiệt kế, 4 – sinh hàn, 5 – bình hứng (erlen).
C. 1 – Đèn cồn, 2 – nhiệt kế, 3 – sinh hàn, 4 – bình hứng (erlen), 5 – Bình cầu có nhánh.
D. 1 – Nhiệt kế, 2 – bình cầu có nhánh, 3 – đèn cồn, 4 – sinh hàn, 5 – bình hứng (erlen).
II. PHẦN TỰ LUẬN:
Câu 1. Các chất và ion dưới đây đóng vai trò acid, base, lưỡng tính hay trung tính theo thuyết BrØnsted – Lowry:$N{a^ + },N{H_4}^ + ,HCO_3^ – ,c{o_2}^ – \;$. Giải thích tại sao?
Câu 2. Viết công thức cấu tạo thu gọn của các chất có công thức phân tử sau ${C_4}{H_8},{C_5}{H_{12}}$.
Câu 3. Vitamin $C$ hay còn gọi là ascorbic acid có vai trò quan trọng đối với cơ thể con người. Các chế phẩm của vitamin $C$ giúp điều trị mệt mỏi, tăng sức đề kháng cho cơ thể, giúp cơ thể mau lành vết thương. Kết quả phân tích nguyên tố của vitamin $C$ thu được thành phần phần trăm về khối lượng như sau: $\% C = 40,91\% $; $\% H = 4,545\% ;\% O = 54,545\% $. Tỉ khối hơi của vitamin C so với khí helium là 44. Xác định công thức phân
tử của vitamin $C$.
ĐÁP ÁN
I. PHẦN TRẮC NGHIỆM
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| C | A | C | D | D | D | D |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| D | D | C | D | A | C | B |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| A | B | A | B | A | A | B |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| B | C | C | B | C | A | B |
II. PHẦN TỰ LUẬN:
Câu 1.
• Chất và ion đóng vai trò trung tính theo thuyết BrØnsted – Lowry: $N{a^ + }$
Giải thích: ion $N{a^ + }$khòng thủy phân trong dung dịch $\left( {{H_2}O} \right)$.
• Chất và ion đóng vai trò acid theo thuyết BrØnsted – Lowry: $NH_4^ + $
Giải thich: $\;NH_4^ + + {H_2}O \rightleftarrows N{H_3} + {H_3}{O^ + }$
Ion $NH_4^ + $nhường proton ${H^ + }$nên có tính acid.
• Chất và ion đóng vai trò base theo thuyết $Br\O $ nsted – Lowry: $CO_3^{2 – }$
Giäi thích: $CO_3^{2 – } + {H_2}O \rightleftarrows HCO_3^ – + O{H^ – }$
Ion $CO_3^{2 – }$ nhận proton ${H^ + }$nên có tính base.
• Chất và ion đóng vai trò lưỡng tính theo thuyết BrØnsted –
Lowry: $HCO_3^ – $
Giäi thích: $\;HCO_3^ – + {H_2}O \rightleftarrows CO_3^{2 – } + {H_3}{O^ + }$
$HCO_3^ – + {H_2}O \rightleftarrows {H_2}C{O_3} + O{H^ – }$
$HCO_3^ – $vừa cho vừa nhận proton nên có tính lường tính.
Câu 2.
${\;^*}{C_4}{H_8}$
(1) $C{H_2} = CH – C{H_2} – C{H_3}$
(2) $C{H_3} – CH = CH – C{H_3}$
(3)
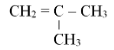
(4)
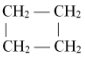
(5)
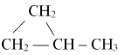
${\;^*}{C_5}{H_{12}}$
(1) $C{H_3} – C{H_2} – C{H_2} – C{H_2} – C{H_3}$
(2)
![]()
(3)
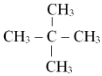
Câu 3.
${M_{vitamin}}C = 44.4 = 176;$
$\% \;{m_O} = \% C + \% H + \% O = 100\% $
$ \Rightarrow $Vitamin $C$ chỉ chứa $C,H$ và $O$.
Gọi công thức tổng quát của $Y$ là ${C_X}{H_y}{O_Z}$
Ta có tỉ lệ: $x:y:z = \frac{{12}}{{12}}:\frac{{16}}{{16}}$
$ = 3,409:4,545:3,409$
$\; = 1:1,333:1$$\; = 3:4:3$
Vậy CTĐGN của vitamin $C$ là ${C_3}{H_4}{O_3}$
$ \Rightarrow CTPT$của vitamin $C$ có dạng: ${\left( {{C_3}{H_4}{O_3}} \right)_n}$
${d_{A/He}} = 44 \Rightarrow {M_A} = 4.44 = 176$
$ \Rightarrow 88n = 176 \Rightarrow n = 2$
Vậy CTPT của A là ${C_6}{H_8}{O_6}$